Anatomía y Fisiología Endocrina, Terminología
Asociada, Exámenes de rutina y Especiales, Procedimientos Especiales.
Farmacología Endocrina, Describir Patologías del Sistema Endocrino aplicando el PAE: Diabetes Mellitus,
Pancreatitis Aguda y Crónica, Hipertiroidismo,
Hipotiroidismo, Bocio. Señalar: Conceptos, Etiologías,
Tipos, Signos y Síntomas, Tratamiento,
Manifestaciones Clínicas, Diagnostico, Complicaciones
y Cuidados
INTRODUCCIÓN
El sistema endocrino está formado por todos aquellos órganos que se encargan de producir y secretar sustancias, denominadas hormonas, hacia al torrente sanguíneo; con la finalidad de actuar como mensajeros, de forma que se regulen las actividades de diferentes partes del organismo.
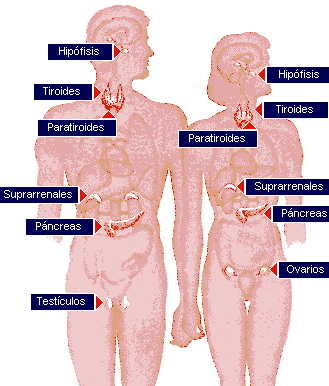
Los órganos principales del sistema endocrino son: el hipotálamo, la hipófisis, la glándula tiroides, las paratiroides, los islotes del páncreas, las glándulas suprarrenales, las gónadas (testículos y ovarios) y la placenta que actúa durante el embarazo como una glándula de este grupo además de cumplir con sus funciones específicas.
El hipotálamo es la glándula que, a través de hormonas, estimula a la hipófisis para que secrete hormonas y pueda estimular otras glándulas o inhibirlas. Esta glándula es conocida como "glándula principal" ya que como se explica anteriormente, regula el funcionamiento de varias glándulas endocrinas.
La hipófisis controla su secreción a través de un mecanismo llamado "retroalimentación" en donde los valores en la sangre de otras hormonas indican a esta glándula si debe aumentar o disminuir su producción.
Hay otras glándulas que su producción de hormonas no dependen de la hipófisis sino que responden de forma directa o indirecta a las concentraciones de sustancias en la sangre, como son: los islotes del páncreas, las glándulas paratiroides y la secreción de la médula suprarrenal que responde a la estimulación del sistema nervioso parasimpático.
El Sistema Endocrino se refiere al conjunto de órganos que tienen como función producir y secretar hormonas al torrente sanguíneo. Las hormonas, en su defecto, son sustancias liberadas por una glándula u órgano que tienen como finalidad regular las actividades de la célula en otras zonas del organismo.Luego de ser liberadas en el medio interno, actúan en él provocado una respuesta fisiológica a cierta distancia de donde fueron segregadas.
Para que las hormonas provoquen una respuesta fisiológica, se unen a unos receptores que se encuentran en la superficie o dentro de las células, a las cuales se les denominan células blanco o dianas.
Las hormonas, según su composición bioquímica y mecanismo de acción, se clasifican en:
- Proteicas: las cuales están compuestas por cadenas de aminoácidos y derivan de la hipófisis, paratiroides y páncreas. Por su composición bioquímica, sus receptores se encuentran en la membrana donde comienza a producirse una serie de reacciones que dan lugar a unos productos bioquímicos que actúan como segundo mensajeros.
- Esteroideas: son derivadas del colesterol y por ende, pueden atravesar la célula y unirse con su receptor que se encuentra en el citoplasma de la célula blanco o diana. Este tipo de hormona es secretado por la corteza suprarrenal y las gónadas.
- Aminas: las cuales son secretadas por la glándula tiroides y de la médula suprarrenal, y su receptor se encuentra en el núcleo de la célula.
Se trata de una disciplina que ha ido formándose al compás de estos estudios y descubrimientos, constituyendo hoy en día una de las ramas más importantes de la medicina y la biología, y la cual abarca la anatomía, fisiología, patología y bioquímica de estas glándulas.
GLÁNDULAS
Concepto de Glándula
"Órgano de origen Epitelial cuya función es la de segregar ciertas
sustancias."(Este concepto es sacado de la deducción de que la glándula es
representada como un órgano por provenir de un sistema y esta compuesto de
tejidos de células epiteliales).
"La glándula es un órgano de origen epitelial cuya función es la de
segregar ciertas sustancias fueras del organismo" (La glándula es un
órgano de tejidos como lo es el corazón u otro con la excepción de que este despide
sustancias en una forma un tanto parecida al sudar de una persona, pero dado
que este órgano desecha sustancias y las deja correr por las venas y arterias,
utilizándolas como cañerías de desagüe para ir a su depósito).
Tipos de glándulas
Las glándulas que existen en el cuerpo poseen distintas formas como
estructuras, por lo que se dividen en distintos grupos según su función, las
siguientes son los grupos más representativos de glándulas segregadoras de
sustancias.
Funciones
El sistema endocrino está compuesto por una serie de glándulas: hipófisis, epífisis, tiroides, paratiroides, cápsulas suprarrenales, páncreas y gónadas (testículos y ovarios), repartidas por todo el cuerpo y que segregan varias sustancias químicas, las ya citadas hormonas, las cuales se vierten en la sangre y se distribuyen a las células. Su actividad se realiza en aquellas células que disponen de unos determinados receptores, capaces de identificar a la hormona correspondiente.
HORMONAS
Definición conceptual de hormona
"Una hormona es una sustancia química secretada en los lípidos
corporales, por una célula o un grupo de células que ejerce un efecto
fisiológico sobre otras células del organismo. Para facilitar la comprensión,
las hormonas son sustancias fabricadas por las glándulas endocrinas, que al
verterse en el torrente sanguíneo activan diversos mecanismos y ponen en
funcionamientos diversos órganos del cuerpo.
"Las hormonas son sustancias químicas producidas por el cuerpo que
controlan numerosas funciones corporales. Las hormonas actúan como
"mensajeros" para coordinar las funciones de varias partes del
cuerpo. La mayoría de las hormonas son proteínas que consisten de cadenas de
aminoácidos. Algunas hormonas son esteroides, sustancias grasas producidas a
base de colesterol.
Las hormonas van a todos lugares del cuerpo por
medio del torrente sanguíneo hasta llegar a su lugar indicado, logrando cambios
como aceleración del metabolismo, aceleración del ritmo cardíaco, producción de
leche, desarrollo de órganos sexuales y otros.
El sistema hormonal se relaciona principalmente con diversas acciones
metabólicas del cuerpo humano y controla la intensidad de funciones químicas en
las células. Algunos efectos hormonales se producen en segundos, otros
requieren varios días para iniciarse y durante semanas, meses, incluso años.
Funciones que controlan las hormonas
Entre las funciones que controlan las hormonas se incluyen:
·
Las actividades de órganos completos.
·
El crecimiento y desarrollo.
·
Reproducción
·
Las características sexuales.
·
El uso y almacenamiento de energía
·
Los niveles en la sangre de líquidos, sal y azúcar.
Fábrica de hormonas
Las encargadas de producir las hormonas son las glándulas endocrinas.
Dentro de ellas, el primer lugar lo ocupa sin duda la hipófisis o glándula
pituitaria, que es un pequeño órgano de secreción interna localizado en la base
del cerebro, junto al hipotálamo. Tiene forma ovoide (de huevo) y mide poco más
de diez milímetros. A pesar de ser tan pequeñísima, su función es fundamental
para el cuerpo humano, por cuanto tiene el control de la secreción de casi
todas las glándulas endocrinas.
La hipófisis está formada por dos glándulas separadas, conocidas como
adenohipófisis y neurohipófisis. La primera corresponde al lóbulo anterior y la
segunda al lóbulo posterior. Se comunica anatómica y funcionalmente a través de
la sangre con el hipotálamo, lo que articula una gran coordinación entre el
sistema nervioso y el endocrino.
La relación hipotálamo-hipófisis es bastante particular, puesto que, a
diferencia del resto del sistema nervioso, en que las neuronas se relacionan
directamente con su efector (órgano terminal que distribuye los impulsos
nerviosos que recibe, activando la secreción de una glándula o contracción de
un músculo), en la hipófisis las neuronas hipotalámicas no hacen contacto
directo con sus efectoras. Estas últimas pasan a la sangre y alcanzan la
adenohipófisis a través de una red capilar que se extiende entre el hipotálamo
y la hipófisis anterior. En consecuencia, los núcleos hipotalámicos son
fundamentales para el normal funcionamiento de la hipófisis.
Regulación de las hormonas
La regulación de hormonas en general incluye tres partes importantes:
Heterogeneidad de la hormona
Regulación hacia arriba y hacia abajo de los receptores
Regulación de la adenil-ciclasa.
Los factores de crecimiento son producidos por expresión local de genes.
Operan por unión a receptores en la membrana celular. Los receptores
generalmente contienen un componente intracelular con tirosina-quinasa. Otros
factores actúan a través de segundos mensajeros, tales como el AMPc y el
fosfoinositol.
Los factores de crecimiento requieren condiciones especiales para actuar;
para inducir la mitogénesis se requiere la exposición secuencial a varios de
ellos, con limitantes importantes en cantidad y tiempo de exposición. Pueden
actuar en forma sinérgica con hormonas; por ejemplo el IGF-I en presencia de
FSH induce receptores para LH.
Receptores de hormonas
"Los receptores de hormonas son selectivos tejidos formados por células
que reaccionan a ciertas sustancias como las hormonas y se aceleran o cambian
en alguna forma según la instrucción y el trabajo que desempeñan".( Esta
definición es dada por conclusión de que las hormonas son sustancias que sirven
como catalizadores y solo algunas células son sensibles a estos).
La acción selectiva de las hormonas en tejidos específicos depende de la
distribución entre los tejidos de los receptores específicos y varias proteínas
efectoras que median las respuestas celulares inducidas por hormonas.
Los receptores tienen dos componentes clave:
a) Dominio específico de unión a ligando donde se une
estereoespecíficamente la hormona correcta para ese receptor.
b) Dominio efector que reconoce la presencia de la hormona unida al domino
del ligando y que inicia la generación de la respuesta biológica
La unión de la hormona al ligando produce cambios finos pero críticos en el
ambiente del sitio efector, de manera que se inicia la transducción, puede
haber interacción con otros componentes celulares para completar la señal del
proceso de transducción.
Los receptores están compuestos principalmente por proteínas, pero tienen
modificaciones secundarias de carbohidratos y pueden estar selectivamente
inmersos en la membrana lipídica, también pueden estar fosforilados, o formar
oligómeros por puentes de disulfuro o interacciones covalentes.
Para ejercer su acción, todas las hormonas deben unirse a su receptor
específico, estas uniones inician mecanismos intracelulares que conllevan las
respuestas celulares. Las hormonas esteroideas y tiroideas son liposolubles y
entran a las células libremente y se unen a las proteínas del citosol. Los
complejos resultantes translocan al núcleo donde se unen a elementos
regulatorios en el DNA estimulando o inhibiendo la transcripción de genes
específicos. Todas las demás hormonas se unen a los receptores celulares
localizados en la membrana de las células diana. Esta unión disipara uno o más
de las vías de transducción que llevan a las respuestas celulares.
Clases y clasificación de Hormonas
Inicialmente las hormonas se clasificaban en tres grupos de acuerdo a su
estructura química: hormonas peptídicas y proteicas, las hormonas asteroideas y
las hormonas relacionadas con aminoácidos.En vertebrados se clasifican en:
1. Aminas
2. prostaglandinas
3. esteroides
4. péptidos y proteinas.
Esteroideas- Solubles en lípidos, se
difunden fácilmente hacia dentro de la célula diana. Se une a un receptor
dentro de la célula y viaja hacia algún gen el núcleo al que estimula su
trascripción.
No esteroideas- Derivadas de
aminoácidos. Se adhieren a un receptor en la membrana, en la parte externa de
la célula. El receptor tiene en su parte interna de la célula un sitio activo
que inicia una cascada de reacciones que inducen cambios en la célula.
La hormona actúa como un primer mensajero y los bioquímicos producidos, que
inducen los cambios en la célula, son los segundos mensajeros.
·
aminas- aminoácidos modificados. Ej : adrenalina, NE
·
péptidos- cadenas cortas de aminoácidos. Ej: OT, ADH
·
proteicas- proteínas complejas. Ej: GH, PTH
·
glucoproteínas- Ej: FSH, LH
La función básica de las hormonas es regular la acción de los sistemas enzimáticos durante determinados procesos, como la fase embrionaria y la primera infancia (actividad del timo), crecimiento, reproducción, reacciones metabólicas, fases de la adolescencia y la menopausia (máxima actividad y decadencia de las gónadas, respectivamente), aunque existen glándulas endocrinas que actúan a lo largo de toda la vida, tales como la tiroides, paratiroides, páncreas e hipófisis.
Algunas funciones del organismo pueden ser activadas o inhibidas mediante las hormonas, las cuales son segregadas en cantidades muy pequeñas. A pesar de esto, una secreción inadecuada o anómala de las hormonas pueden producir trastornos en el organismo, que en determinadas ocasiones derivan en graves consecuencias para la salud. La patología hormonal puede deberse a una hipersecreción (por exceso o hiperfunción), o una hiposecreción (por defecto o hipofunción).
Si existe hiperfunción de una glándula se suele recurrir a la administración de sustancias antagonistas para reducir su actividad, evitando así que segregue más cantidad de hormona de la necesaria; en algunos casos incluso puede estar indicado la extirpación de una parte de la glándula. Si existe hipofunción de una glándula se suele recurrir a su estimulación, con objeto de que segregue la cantidad mínima imprescindible, o también a la administración de la hormona que falta o es escasa en el organismo.
Las Glándulas son órganos cuya función es la de fabricar productos especiales expensas de los materiales de la sangre Según su función se dividen en:
Glándulas endocrinas
Los tejidos productores de hormonas pueden clasificarse en tres grupos: las glándulas endocrinas propiamente dichas, cuya función es la producción exclusiva de hormonas; glándulas endo-exocrinas, que producen también otro tipo de secreciones además de hormonas; y determinados tejidos no glandulares, como el tejido nervioso del sistema nervioso autónomo, que produce sustancias parecidas a las hormonas.
Entre las glándulas que producen hormonas se distinguen las siguientes:
Hipófisis
La hipófisis es una glándula endocrina de pequeño tamaño, situada en la parte anteroinferior del cráneo en una excavación del esfenoides (silla turca) unida al hipotálamo por medio del tallo hipofisario. Se llama también glándula pituitaria. En ella se distinguen tres partes: adenohipófisis, zona intermedia y neurohipófisis. La parte intermedia en el hombre carece de importancia.
La adenohipófisis segrega siete hormonas: la del crecimiento (somatotrina), la corticotropa (actúa sobre la corteza suprarrenal), la tirotropa (actúa sobre el tiroides), las hormonas folicoloestimulantes y luteinizantes (que actúan sobre las gónadas; también se llaman gonadotropinas), la prolactina (que actúa sobre las mamas) y la hormona melanotropa (que actúa sobre la pigmentación de la piel). La neurohipófisis no segrega hormona alguna; la oxitocina y la hormona antidiurética son elaboradas en el hipotálamo y llegan a la neurohipófisis siguiendo las fibras nerviosas del tallo hipofisario.

Ilustración del hipotálamo y la glándula hipófisis o pituitaria
Glándulas endocrinas
Tiroides
 a tiroides es una glándula endocrina situada en la región anteroinferior del cuello. Está formada por dos lóbulos simétricos unidos por un puente de tejido que cruza por delante de la tráquea, denominado istmo. Embriológicamente, deriva de los arcos branquiales tercero y cuarto, y del corpúsculo ultimobranquial del 6.º arco, que origina las células C o parafoliculares, productoras de tirocalcitonina.
a tiroides es una glándula endocrina situada en la región anteroinferior del cuello. Está formada por dos lóbulos simétricos unidos por un puente de tejido que cruza por delante de la tráquea, denominado istmo. Embriológicamente, deriva de los arcos branquiales tercero y cuarto, y del corpúsculo ultimobranquial del 6.º arco, que origina las células C o parafoliculares, productoras de tirocalcitonina.
El tiroides está rodeado por una cápsula fibrosa, de tejido conectivo, que emite prolongaciones hacia su interior, separando el tejido hormonal en lobulillos, que a su vez se dividen en folículos, donde se agrupan las células productoras de las hormonas tiroideas. En el espesor del tejido conjuntivo aparecen grupos de células más grandes, que son las células parafoliculares. Su peso oscila de 30 a 35 g. Es de consistencia blanda y elástica. Elabora la tiroxina u hormona tiroidea que actúa e influye en la producción de calor, en el crecimiento y maduración del organismo humano; posee efecto diurético, reduce los depósitos de glucógeno hepático, etc.
La hormona que segrega la tiroides (la tiroxina) puede observarse en esta imagen, en forma de pequeños gránulos anaranjados dentro de los tejidos de la glándula
El funcionamiento del tiroides está regulado por la hormona tireoestimulante segregada por la hipófisis, regulada a su vez por otra hormona producida por el hipotálamo. Por su parte, la tirocalcitonina interviene de manera fundamental en el metabolismo del calcio en el organismo. La disminución funcional de la glándula tiroidea en los jóvenes es causa del cretinismo y en los adultos de mixedema.
Paratiroides
Las paratiroides son glándulas endocrinas que se sitúan en el cuello, en los bordes de la glándula tiroides. Producen la hormona paratiroidea o parathormona (PTH). Se componen habitualmente de cuatro glándulas (dos superiores y dos inferiores), aunque pueden llegar a existir incluso más de cinco.
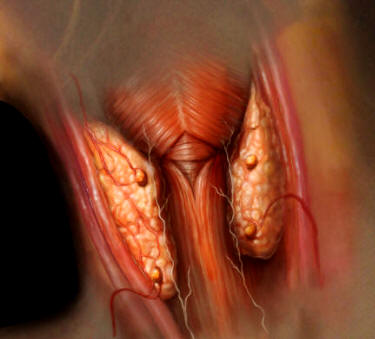
Ilustración de las glándulas tiroides y paratiroides, situadas en el cuello
Ovarios
Los ovarios, u órganos femeninos de la reproducción, además de producir óvulos o huevos, también segregan un grupo de hormonas denominadas estrógenos, necesarias para el desarrollo de los órganos reproductores y también de las características sexuales secundarias, como la distribución de la grasa, amplitud de la pelvis o crecimiento de las mamas, entre otras.
Ilustración del útero humano mostrando las trompas de Falopio, ovarios, cuello uterino y vagina
La progesterona es una hormona segregada por un cuerpo amarillo o lúteo del ovario, que modifica la mucosa del útero haciéndola apta para albergar al óvulo fecundado. Es indispensable para el mantenimiento del embarazo. Su secreción es regulada por la hipófisis.
Los ovarios también elaboran una hormona llamada relaxina que, junto con la progesterona y estrógeno, actúa en la relajación de la sínfisis púbica, favoreciendo la dilatación del cuello del útero y facilitando de esta forma el parto.
Glándulas endocrinas
Testículos
 os testículos son cada una de las dos glándulas ovoideas masculinas, encerradas en un sistema de cubiertas que reciben el nombre genérico de bolsas testiculares y que están suspendidas del extremo inferior del cordón espermático.
os testículos son cada una de las dos glándulas ovoideas masculinas, encerradas en un sistema de cubiertas que reciben el nombre genérico de bolsas testiculares y que están suspendidas del extremo inferior del cordón espermático.
Como glándula de secreción externa producen los espermatozoides y como glándula de secreción interna las hormonas sexuales (testosterona) que determinan, desarrollan y mantienen los caracteres sexuales secundarios. En los mamíferos, contrariamente a los demás animales, se sitúan en el exterior del organismo. Se denominan también gónadas masculinas.

Ilustración del sistema reproductor masculino mostrando los testículos
Páncreas
El páncreas es una glándula de función endocrina y exocrina situada en el abdomen detrás del estómago, entre el duodeno y el bazo. Está formada por tres porciones, cabeza, tronco y cola. Desemboca en el duodeno.

El páncreas exocrino elabora el jugo gástrico necesario para la digestión. Su secreción endocrina es la insulina, producida por las células beta de los islotes de Langerhans. La insulina actúa sobre el metabolismo de los hidratos de carbono, proteínas y grasas, aumentando la tasa de utilización de la glucosa y favoreciendo la formación de proteínas y el almacenamiento de grasas. El glucagón aumenta de forma transitoria los niveles de azúcar en la sangre mediante la liberación de glucosa procedente del hígado.
Placenta
La placenta es un órgano que se forma durante el embarazo a partir de la membrana que rodea al feto. Se adhiere a la superficie interior del útero y de ella nace el cordón umbilical. Este órgano secreta una hormona denominada gonadotgropina coriónica, que se encuentra presente en la orina durante la gestación, constituyendo la base para las pruebas de embarazo. La placenta produce progesterona y estrógenos, somatotropina coriónica (relacionada con hormona del crecimiento), lactógeno placentario y hormonas lactogénicas.
Metabolismo Hormonal
La liberación de las hormonas depende de los niveles en sangre de otras hormonas y de ciertos productos metabólicos bajo influencia hormonal, así como de la estimulación nerviosa. La producción de las hormonas de la hipófisis anterior se inhibe cuando las producidas por la glándula diana particular, la corteza suprarrenal, el tiroides o las gónadas circulan en la sangre. Por ejemplo, cuando hay una cierta cantidad de hormona tiroidea en el torrente sanguíneo la hipófisis interrumpe la producción de hormona estimulante del tiroides hasta que el nivel de hormona tiroidea descienda. Por lo tanto, los niveles de hormonas circulantes se mantienen en un equilibrio constante. Este mecanismo, que se conoce como homeostasis o realimentación negativa, es similar al sistema de activación de un termostato por latemperatura de una habitación para encender o apagar una caldera.
La administración prolongada procedente del exterior de hormonas adrenocorticales, tiroideas o sexuales interrumpe casi por completo la producción de las correspondientes hormonas estimulantes de la hipófisis, y provoca la atrofia temporal de las glándulas diana. Por el contrario, si la producción de las glándulas diana es muy inferior al nivel normal, la producción continua de hormona estimulante por lahipófisis produce una hipertrofia de la glándula, como en el bocio por déficit de yodo.
La liberación de hormonas está regulada también por la cantidad de sustancias circulantes en sangre, cuya presencia o utilización queda bajo control hormonal. Los altos niveles de glucosa en la sangre estimulan la producción y liberación de insulina mientras que los niveles reducidos estimulan a las glándulas suprarrenales para producir adrenalina y glucagón; así se mantiene el equilibrio en el metabolismo de los hidratos de carbono. De igual manera, un déficit de calcio en la sangre estimula la secreción de hormona paratiroidea, mientras que los niveles elevados estimulan la liberación de calcitonina por el tiroides.
La función endocrina está regulada también por el sistema nervioso, como le demuestra la respuesta suprarrenal al estrés. Los distintos órganos endocrinos están sometidos a diversas formas de control nervioso. La médula suprarrenal y la hipófisis posterior son glándulas con rica inervación y controladas de modo directo por el sistema nervioso. Sin embargo, la corteza suprarrenal, el tiroides y las gónadas, aunque responden a varios estímulos nerviosos, carecen de inervación específica y mantienen su función cuando se trasplantan a otras partes del organismo. La hipófisis anterior tiene inervación escasa, pero no puede funcionar si se trasplanta.
Se desconoce la forma en que las hormonas ejercen muchos de sus efectos metabólicos y morfológicos. Sin embargo, se piensa que los efectos sobre la función de las células se deben a su acción sobre las membranas celulares o enzimas, mediante la regulación de la expresión de los genes o mediante el control de la liberación de iones u otras moléculas pequeñas. Aunque en apariencia no se consumen o se modifican en el proceso metabólico, las hormonas pueden ser destruidas en gran parte por degradación química. Los productos hormonales finales se excretan con rapidez y se encuentran en la orina en grandes cantidades, y también en las heces y el sudor.
Las alteraciones en la producción endocrina se pueden clasificar como de hiperfunción (exceso de actividad) o hipofunción (actividad insuficiente). La hiperfunción de una glándula puede estar causada por un tumor productor de hormonas que es benigno o, con menos frecuencia, maligno. La hipofunción puede deberse a defectos congénitos, cáncer, lesiones inflamatorias, degeneración, trastornos de la hipófisis que afectan a los órganos diana, traumatismos, o, en el caso de enfermedad tiroidea, déficit de yodo. La hipofunción puede ser también resultado de la extirpación quirúrgica de una glándula o de la destrucción por radioterapia.
La hiperfunción de la hipófisis anterior con sobreproducción de hormona del crecimiento provoca en ocasiones gigantismo o acromegalia, o si se produce un exceso de producción de hormona estimulante de la corteza suprarrenal, puede resultar un grupo de síntomas conocidos como síndrome de Cushing que incluye hipertensión, debilidad, policitemia, estrías cutáneas purpúreas, y un tipo especial deobesidad. La deficiencia de la hipófisis anterior conduce a enanismo (sí aparece al principio de la vida), ausencia de desarrollo sexual, debilidad, y en algunas ocasiones desnutrición grave.
Una disminución de la actividad de la corteza suprarrenal origina la enfermedad de Addison, mientras que la actividad excesiva puede provocar el síndrome de Cushing u originar virilismo, aparición de caracteres sexuales secundarios masculinos en mujeres y niños. Las alteraciones de la función de las gónadas afectan sobre todo al desarrollo de los caracteres sexuales primarios y secundarios. Las deficiencias tiroideas producen cretinismo y enanismo en el lactante, y mixedema, caracterizado por rasgos toscos y disminución de las reacciones físicas y mentales, en el adulto. La hiperfunción tiroidea (enfermedad de Graves, bocio tóxico) se caracteriza por abultamiento de los ojos, temblor y sudoración, aumento de la frecuencia del pulso, palpitaciones cardiacas e irritabilidad nerviosa.
La diabetes insípida se debe al déficit de hormona antidiurética, y la diabetes mellitus, a un defecto en la producción de la hormona pancreática insulina, o puede ser consecuencia de una respuesta inadecuada del organismo.
TERMINOLOGIA ASOCIADA AL SISTEMA ENDOCRINO
HORMONA
Mensajeros químicos
que ayudan a nuestro cuerpo a efectuar tareas diversas. Las hormonas son
segregadas por las glándulas
endocrinas y enviadas a continuación por todo el cuerpo para
estimular ciertas actividades. La insulina, por ejemplo, es una hormona bien
conocida que facilita la digestión de los alimentos. Las hormonas regulan
nuestro crecimiento, digestión, reproducción y funciones sexuales.
ALDOSTERONA: Aumenta la reabsorción renal de sodio.
Aumenta la secreción de potasio e hidrogeniones.
ANTAGONISTAS: son moléculas que se unen al receptor pero en
lugar de promover la acción de la célula diana, bloquean el receptor impidiendo
que la hormona se una a él.
CALCITONINA: Favorece el depósito de calcio en los
huesos. Disminuye la concentración calcio 2+ extracelular.
CÉLULAS DIANA: también llamadas células blanco, células
receptoras o células efectoras, poseen receptores específicos para las hormonas
en su superficie o en el interior. Cuando la hormona llega a la célula diana y
hace contacto con el receptor “como una llave con una cerradura“, la célula es
impulsada a realizar una acción específica
.
CÉLULAS
ENDOCRINAS: son células
especializadas en la producción de hormonas. Pueden estar organizadas en un
único órgano – glándula, estar concentradas en pequeños grupos, o encontrarse
aisladas.
CORTISOL: Controla el metabolismo de proteínas,
carbohidratos y grasas. Posee acción antiinflamatoria.
ERITROPOYETINA: Estimula la producción de eritrocitos.
ESTRADIOL: Producida por las células de la granulosa y
la teca en el folículo. Induce el desarrollo embrionario del sistema
reproductor femenino. Induce las características sexuales secundarias
femeninas.
FEROMONAS: son sustancias que permiten la comunicación entre
individuos de la misma especie. Las funciones más conocidas de las feromonas
incluyen la atracción de pareja en la época de apareamiento y la marcación del
territorio. Los receptores para las feromonas se encuentran en el órgano
vomeronasal, el cual se encuentra en el interior de la cavidad nasal.
FSH: Hormona folículo
estimulante. Estimula el desarrollo folicular en la hembra. Estimula la
espermatogenesis en el macho.
INSULINA: Segregación que
estimula la disminución de azucar en la sangre
GLUCEMIA: Azúcar que circula por la sangre
ACROMEGALIA
Es una enfermedad
endocrina debida a un exceso de producción de hormona de crecimiento
(GH), que determina un aumento desproporcionado del tamaño de las extremidades,
dolores de cabeza y articulares y alteración de las proporciones faciales
PRUEBAS ESPECIALES UTILIZADAS EN EL SISTEMA
a)Dosificación de GH basal
Los niveles basales de GH (en ayunas, reposo absoluto y 20-22º C de
tem-peratura) son de 0-5 ng/ml. Las cifras normales o bajas no tienen valor
diagnósti-co, ya que la secreción de GH es pulsátil y varía mucho durante el
día.Habitualmente hay que recurrir a otras determinaciones y pruebas
funcionales.
b)IGF-I
Los niveles de este factor se relacionan directamente con la secreción de
GH,por lo que sirven para detectar su deficiencia, ya que, debido a que el
IGF-I pre-senta una larga vida media, a diferencia de la GH,
los resultados obtenidos a partirde una muestra reflejan sus
concentraciones medias durante el día. Los valores nor-males oscilan entre
70 y 400 ng/ml, aunque son más bajos en la primera infancia ydisminuyen
progresivamente a partir de los 50 años. Es conveniente ajustarlos
poredad y sexo. Además descienden en la malnutrición, la diabetes y la
insuficienciarenal. Disminuyen en el enanismo hipofisario y aumentan en la
acromegalia
c)IGFBP-3
Esta es la más importante de las seis proteínas trasportadoras de IGF-I
ensangre. La utilidad de la determinación de esta proteína es similar a la del
propioIGF-I y no ofrece ventajas que justifiquen su determinación.
d)Pruebas de estimulación
Se utilizan para el estudio de presuntos casos con hipoproducción de
GH,especialmente en niños con talla baja. Existen pruebas fisiológicas, basadas
enmedir la respuesta de GH durante el sueño o tras un ejercicio reglado. Más
com-plejas, aunque más exactas, son las pruebas farmacológicas, todas con un
funda-mento similar, que en general se consideran normales cuando se obtiene un
picode GH superior a 10 ng/ml. Deben hacerse varios tests, ya que sólo se
consideransignificativos cuando al menos dos son positivos.
e)Pruebas de supresión
Test de supresión mediante
hiperglucemia: Tras la administración de 75 g de glucosa v.o. se obtiene un descenso de
GH por debajo de 0,5 ng/ml en sujetos normales, pero no en los acromegálicos, en los que incluso se puede producir una
elevación paradójica.
Otras: La dopamina produce una respuesta
menor en los sujetos con acro-
megalia que en los normales, e incluso
una disminución paradójica.
ACTH
Es un polipéptido de 39 aminoácidos y un
PM de 4.500. La ACTH proviene de una prohormona de alto PM, la
proopiomelanocortina (POMC), que da origen a la ACTH y a la lipotropina, y ésta, a su vez, a
la α-lipoprotina (α-LPH) y la β-endorfina. Existen tres factores principales
que controlan la liberación de hormona liberadora de corticotropina (CRH) y ACTH: las concentraciones plasmáticas de
cortisol ibre (inhibe la CRH y la ACTH), el estrés (incrementa ambas) y el ciclo
sueño-vigiia (escasa antes de despertar). Los valores normales de la concentración
plasmática
de ACTH, determinada a las 8 horas de la mañana, son aquéllos inferiores a
18 pmol/l.
Hormona estimulante
del tiroides (TSH)
La TSH es una glucoproteína de PM
28.000 constituida por una unidad
α y otra β, codificadas por genes
diferentes.
El intervalo de referencia es de 0,1 a 4
mU/l aproximadamente, aunque la
TSH se segrega en pulsos y tiene
concentraciones más altas durante la noche. El principal factor que estimula la síntesis de TSH es la hormona liberadora
de tirotropina (TRH) hipotalámica, con la cual la TSH establece un sistema de
retroalimentación negativo.
Los métodos de análisis más utilizados
son radioinmunoanálisis, inmunolu-
minometría basada en el principio de quimioluminiscencia
y otros ensayos inmunoenzimáticos, inmunorradiométricos, etc.
Los valores están elevados en el
hipotiroidismo primario, normales o disminuidos en el hipotiroidismo secundario y
muy reducidos o casi indetectables en pacientes con hipertiroidismo. El diagnóstico no se debe realizar hasta conocer
los resultados de la T3 y T4
.
Prolactina
Actúa directamente sobre la secreción
mamaria. Es una hormona adenohi-
pofisaria segregada por las células
lactotropas, que circula en el suero de los individuos sanos principalmente en forma monomérica con un grado variable de glicosilación, aunque también en forma desamido, fosforilada, sin puente disulfuro y como macroprolactina. De ahí que esta hormona goce de una gran variedad de actividades biológicas.
La prolactina se libera en forma de
pulsos, cuya amplitud es muy marcada
en las fases iniciales del sueño. El
control de secreción es complejo, aunque el principal factor inhibidor es la dopamina producida en el hipotálamo, con la
que establece una contrarregulación negativa. La TRH y el péptido intestinal
vasoactivo (VIP) estimulan la secreción, lo mismo que los estrógenos circulantes,
pero salvo durante el embarazo, predomina el tono inhibidor de la secreción.
Se analiza por métodos inmunométricos
como el enzimoinmunoensayo, que actualmente emplea anticuerpos
monoclonales. Dado que el estrés incrementa la liberación de dopamina, se recomienda hacer la toma de muestras al cabo de 20 minutos de insertada la cánula de extracción.
El límite máximo de la normalidad por la
mañana en ayudas y en sujetos
adultos es de 20 ng/ml en mujeres y 15
ng/ml en varones. Aparte del embarazo, cifras superiores a 200 ng/ml son prácticamente diagnósticas de prolactinoma.
Las pruebas dinámicas de secreción de
prolactina más utilizadas son las
siguientes:
—
Estímulo con TRH: Tras toma
basal se administran 200 μg de TRH y
se hacen tomas seriadas durante una hora. Lo normal es que la prolac-
tina aumente al menos al doble del valor basal. Niveles basales muy
bajos sin respuesta indican hipopituitarismo o uso de agonistas dopa-
minérgicos. Niveles basales elevados sin respuesta al estímulo indican
hiperprolactinemia pero no discriminan la causa.
se hacen tomas seriadas durante una hora. Lo normal es que la prolac-
tina aumente al menos al doble del valor basal. Niveles basales muy
bajos sin respuesta indican hipopituitarismo o uso de agonistas dopa-
minérgicos. Niveles basales elevados sin respuesta al estímulo indican
hiperprolactinemia pero no discriminan la causa.
—
Bloqueo con domperidona: incrementa la
secreción en sujetos norma-
les pero no en prolactinoma o “pseudoprolactinoma”; la diferencia es
que en el primer caso sube la TSH y en el segundo, no.
les pero no en prolactinoma o “pseudoprolactinoma”; la diferencia es
que en el primer caso sube la TSH y en el segundo, no.
Las técnicas de neuroimagen son
imprescindibles en el diagnóstico diferencial de una hiperprolactinemia
Los procedimientos más utilizados para su
determinación son radio e inmunoenzimoanálisis.
Las gonadotrofinas deben valorarse
siempre junto con las hormonas periféricas segregadas por las gónadas.
Proporcionan información sobre la función hipotálamo-hipofisaria, diferenciando entre los síndromes de disfunción gonadal primarios y secundarios. Los niveles de gonadotrofinas aumentan en mujeres en estado de hipofunción ovárica primaria, como el síndrome de Turner y en la menopausia. Igualmente se elevan en la hipofunción ovárica secundaria.
En el síndrome de ovarios poliquísticos es habitual que la FSH sea normal o baja
mientras que la LH se eleva sensiblemente. En el hombre se incrementan en casos de hipogonadismo primario o secundario. En ambos sexos, la disminución de FSH y LH junto a una insuficiencia gonadal sugiere un trastorno en el hipotálamo o en la hipófisis y se relaciona con alteraciones en los caracteres sexuales
secundarios.
Sin embargo, las concentraciones basales de gonadotrofinas pueden ser muy bajasen sujetos normales y es necesario recurrir a alguna de las siguientes pruebas
de estimulación:
—
Prueba de estimulación con LHRH (GnRH)
Mientras que en el etapa prepuberal la
respuesta hipofisaria de la LH y la
FSH ante la LHRH son similares, en la
pubertad la respuesta de la LH se verá incrementada y la de la FSH permanecerá sin cambios. En el sujeto normal tras la administración de 100 μg i.v. de LHRH las concentraciones de LH suelen aumentar de 4-5 veces, alcanzando el pico a los 30 minutos. La FSH sube algo más despacio y a un nivel algo inferior. La LH suele subir más en mujeres y la FSH en varones. De todas formas el intervalo de las respuestas en sujetos normales es muy amplio, no superando algunos el doble de las concentraciones de LH basales.
En pacientes con enfermedad hipofisaria
o hipotalámica los resultados pueden ser normales o anormales, por lo que
una respuesta normal no descarta estas patologías, aunque sí en cambio es indicativo de estas patologías un resultado anómalo. La mayor utilidad de la prueba se presenta cuando hay una respuesta de la LH por debajo de lo normal en el hipogonadismo secundario. En este caso si tras la infusión de LHRH durante una semana restablece los resultados es probable que aquel trastorno sea de origen hipotalámico.
—
Prueba del clomifeno:
El clomifeno tiene un débil efecto
estrogénico periférico y un efecto central
antiestrogénico, ya que bloquea los
receptores estrogénicos a nivel hipotálamo hipofisario. Se administra a dosis de 3 mg/kg/día durante 7 días y se miden LH
y FSH en diversos momentos. Lo normal es que ambas gonadotrofinas se eleven al menos al doble del valor basal al cabo de 10 días, respuesta que no se produce
en hipopituitarismos selectivos o globales ni en la anorexia nerviosa. Esta prueba
no es aplicable en la etapa pre y peripuberal ya que no hay respuesta.
Vasopresina
La diabetes insípida es una enfermedad en
que se aprecia una disminución de la actividad de la vasopresina u
hormona antidiurética (ADH), tanto por el descenso de sus concentraciones (diabetes insípida central) como por la falta de
respuesta a la hormona en el caso alteración tubular renal (diabetes insípida
nefrogénica). Debe diferenciarse de los pacientes con polidipsia primaria que ingieren agua de forma exagerada (potomanía).
—
Niveles basales de vasopresina
La determinación de las concentraciones
plasmáticas de ADH mediante
radioinmunoanálisis es muy costosa y se
reserva a situaciones cuyo diagnóstico no ha sido esclarecido por otras pruebas. Por otra parte, sus niveles varían a lo
largo del día con un máximo a última hora de la noche y en la madrugada y un mínimo a
media tarde. Los niveles plasmáticos de ADH oscilan entre 1,4 y 5,6 pmol/l (1,5
a 6 ng/l).
—
Test de restricción hídrica
Esta prueba admite dos modalidades,
corta y larga. En ambos casos hay que suspender al menos 12 horas antes el
aporte de cafeína, alcohol o nicotina, que modifican la secreción de ADH.
En la prueba corta se canaliza una vena
periférica, se suprime el aporte de
líquidos, se recogen periódicamente
muestras de orina y se controla el peso corporal a partir del la 4ª hora, ya que si se pierde más del 3% del peso corporal
se debe interrumpir la prueba. Al cabo
de 8 horas se administran 2 μg de desmopresina i.v. o 20 mg intranasales y se permite ingerir agua, recogiendo orina cada
hora durante las 4 horas siguientes.
En sujetos normales, la orina de las 8 horas de deprivación hídrica debe tener una osmolalidad superior a 600 mOsm/kg mientras que la plasmática no debe superar los 295 mOsm/kg, al tiempo que la diuresis debe disminuir por debajo de 0,5 ml/minuto. En la diabetes insípida no se
logran
estos límites. La desmopresina incrementa la osmolalidad urinaria por encima de 700 mOsm/kg si hay diabetes insípida hipotalámica, pero no si es nefrógena. En la potomanía la osmolalidad plasmática basal es menor de 280 mOsm/kg y la respuesta a la sed menos marcada.
La prueba larga está indicada cuando la
corta no ofrece resultados conclu-
yentes. El método es similar y los
objetivos a valorar similares, aunque tardan más en conseguirse.
Oxitocina
Existe una gran variabilidad en los
niveles de esta hormona, que es independiente del ritmo circadiano y cuya
función fisiológica se concentra en el parto y a lactancia. Los valores oscilan en ambos sexos entre 1 y 4 pmol/l (1,25 a 5
ng/l).
Concentraciones que serán en el caso de la mujer inferiores en la fase preovulatoria (unos 2 pmol/l) y más altas en la ovulación (de 4 a 8 pmol/l). Se puede
apreciar también un incremento importante durante el parto.
Determinación de las concentraciones de
cortisol
El método más utilizado actualmente es
el de HPLC (cromatografía líquida
de alto rendimiento). Existen también
técnicas de radioinmunoanálisis de cromatografía gaseosa con espectrometría de masa. Su concentración plasmática
presenta un ritmo circadiano con un nivel máximo entre las 4 y 6 a.m. Los valores de
su concentración a las 8 a.m. se hallan entre 7 y 20 μg/dl, mientras que a las 4
p.m.
son de 3 a 12 μg/dl. Este ritmo se rompe en el síndrome de Cushing, en el que es frecuente que las cifras vespertinas superen a las matutinas.
Habitualmente se deberán realizar,
aparte de las determinaciones de cortisol plasmático, una serie de pruebas
funcionales cuando existen sospechas clínicas, debido a la necesidad de realizar el diagnóstico diferencial del origen central.
FARMACOLOGIA DEL SISTEMA ENDOCRINO
1. Insulina
Utilizada en el tratamiento de la Diabetes mellitus. (Tipos 1 y 2)
En condiciones normales es producida por las células β del pαncreas, cuyo principal
estimulo para la secreciσn de insulina es la glucosa y otros azucares.
En la patogénesis y progresión de la enfermedad están involucrados:
a- La resistencia a la Insulina que es la incapacidad de
los tejidos blancos de responder a los niveles
normales de Insulina circulante.
b- El daño progresivo en la función de las células β del pαncreas que
lleva a la secreción anormal y deficiente de Insulina.
c- Los factores de riesgo ambientales incluyen obesidad,
inactividad física, edad avanzada, historia previa de diabetes gestacional.
La resistencia a la insulina precede por un largo período al desarrollo de esta enfermedad, que sigue una
secuencia:
En la primera
fase, los niveles de glucosa en sangre permanecen normales y la resistencia a
la Insulina aumenta en el tejido muscular y adiposo. Para mantener la
normoglicemia se eleva la secreción de Insulina por parte de las células β
agravándose la resistencia.
En la segunda
fase, la hiperglicemia post-prandial se
observa cuando la hipersecreción de Insulina no es lo suficientemente adecuada
para mantener normales los niveles de glucosa en sangre.
En la tercera
fase, la secreción de Insulina declina
debido a la falla de las células β pancreáticas y da como resultado la
hiperglicemia en ayuno y la manifestación clínica de la Diabetes tipo 2.
Clasificación de los preparados de insulina
Origen: bovina,
porcina y humana.
Duración: rápida, intermedia y prolongada.
La insulina porcina difiere de la humana en un solo
aminoácido, alanina en lugar de treonina en la posición B30.
La insulina bovina difiere en tres aminoácidos, además del cambio que presenta la insulina porcina, en
las posiciones A8 y A10 la treonina e isoleucina estan reemplazadas por alanina
y valina.
La insulina humana desplazo el uso de las anteriores y la
misma se sintetiza por técnicas de ingeniería genética.
Insulinas de acción rápida
Insulina regular ó cristalina: primera insulina humana. Es
una cristalización de la insulina (transparente) con cloruro de zinc, ya que la
insulina en el páncreas se almacena con el zinc. Su inicio de acción es a los
30-60 min si se administra por vía sub-cutánea y es a los 5-15 min si se
administra por vía endovenosa. Alcanza concentraciones pico a las 2-4 hrs y su
acción dura de 6 a 8 hrs.
Insulina Lis Pro (de acción ultracorta): es un análogo de la
insulina donde se sustituyen dos aminoácidos (lisina y prolina) en la cadena B,
lo que conlleva un cambio conformacional mejorando la velocidad de absorción (Mas por vía sub-cutánea
que la insulina regular). De aspecto cristalino. Su inicio de acción es en 5-15
minutos, el pico es a la 1 ó 2 hrs aproximadamente y la duración es de 4 a 5
hrs. Esta variedad de preparación tiene la ventaja que puede ser administrada
inmediatamente antes de las comidas.
Insulinas de acción intermedia
Insulina NPH (Neutral Protamin Hagedom): es una suspensión
de protamina a pH neutro que por esta razón no necesita refrigeración para ser guardada. La protamina al
mezclarse con la insulina permite que la absorción por vía cutánea se haga más
lenta. De aspecto lechoso, turbio. Su inicio de acción es en 1-2 hrs, el pico
es a las 6-12 hrs y la duración es de 18 a 24 hrs.
Insulina lenta: igual a la anterior, en la práctica clínica
la más usada es la insulina NPH.
Insulinas de acción prolongada
Insulina ultralenta: inicia su acción entre las 4 y 6 hrs,
tiene el pico entre las 14 y 20 hrs y la duración es de 20 a 36 hrs.
Glargina: inicia
su acción en 2-5 hrs, alcanza concentraciones pico a las 5-20 hrs y su duración
es de 24 hrs.
Cinética
Absorción. Vías de Administración
Las vías de administración son la intravenosa, la subcutánea y la
intramuscular. Esto es debido a que la insulina es un péptido y por ende se
degrada por enzimas digestivas, razón por la cual su
biodisponibilidad oral es prácticamente nula. Cabe destacar que la vía más
usada es la subcutánea, excepto en casos de emergencia donde la vía que se
utiliza es la intravenosa, siendo la insulina regular la única que puede ser
administrada por esta vía.
La absorción por vía subcutánea puede variar hasta en un 25%
y esto puede ser por la concentración de insulina y la dosis; también los
masajes en la zona de inyección, el ejercicio y el calor pueden aumentar su absorción por
aumentar el flujo sanguíneo.
En la actualidad, existen varios sistemas que se están desarrollando para la administración de insulina por vía inhalatoria. Hasta
el momento, según los resultados, esta vía ha demostrado ser efectiva y segura,
pero aún no se dispone para el uso generalizado.
Distribución
La insulina circula en sangre como monómero libre y su volumen de distribución se aproxima al del volumen
extracelular.
La vida media en plasma es de 5 a 8 minutos.
Metabolismo. Eliminación
Se degrada principalmente en hígado, riñón y músculo.
Alrededor de un 50% se metaboliza en hígado. La insulina se filtra en los
glomérulos renales y se reabsorbe en los túbulos, lugar donde también sufre
desintegración. El deterioro de la función renal prolonga la vida media de la
insulina
Efectos adversos
Hipoglicemia: que se asocia a sobre-dosificación, retraso en
la ingestión de glucosa y ejercicio sin ajuste de dosis.
Alergias y resistencia a la insulina: se produce por
proteínas extrañas en el caso de las insulinas de origen animal ó por impurezas
en las preparaciones. Se define que hay resistencia a la insulina cuando el
paciente requiere + 100 U/día.
Lipodistrofias: puede haber atrofia e hipertrofias; las
mismas se producen por la lipogenesis exagerada que puede ocasionar la
administración de
insulina. Generalmente no se observan con el uso de insulinas humanas y si se
rota el sitio de inyección de la insulina.
Edema: que puede aparecer al inicio de tratamiento en el
sitio local de la inyección ó en los miembros inferiores.
·
Sulfonil – Ureas
·
Meglitinidas
Sulfonil – Ureas
·
1ra Generación
Tolbutamida
Clorpropamida
Tolazamida
Ya estas drogas de 1ra generación no se utilizan en la
clínica debido a que producían muchos efectos adversos y estas han sido
sustituidas por la aparición de nuevas drogas de 2da generación. (Clorpropamida,
sin embargo, era la más utilizada)
Con respecto a la cinética de las de 1ra generación es
importante señalar que Clorpropamida es la de mayor potencia y la que posee la vida media mas larga
(24-72 horas). Las demás son de menor potencia y de vida media mas corta. Todas
tienen excreción renal, a diferencia de las drogas de 2da generación que como se vera mas
adelante tienen excreción renal y fecal.
·
2da Generación
Glicazida
Glipizida
Gliburida (Glibenclamida)
Glimepirida
Cinética de las drogas de 2da generación
Glipizida
|
Gliburida
(Glibenclamida)
|
Glimepirida
|
|
Potencia
|
100
|
150
|
450
|
T ½
|
16-24 horas
|
18-24 horas
|
24 horas
|
Metabolitos
|
Inactivos-Activos
|
Moderadamente activos
|
Débilmente activos
|
Excreción
|
Urinaria y 12% fecal
|
50% urinaria y 50% fecal
|
60% urinaria y 40% fecal
|
Cabe destacar que Glibenclamida y Glimepirida son las más
utilizadas en la clínica por ser las de mayor potencia y que todas las de 2da
generación tienen excreción renal y fecal.
Mecanismo de acción de las Sulfonil-Ureas
·
Su principal mecanismo de acción es
estimular la liberación de insulina en la diabetes tipo II. Esto mediante la unión
al receptor de k+ sensible al ATP presente en la célula β , lo que disminuye la conductancia
del k+ , induce la despolarización del interior de la célula, se produce la
entrada de Ca+2 y se activa el sistema de secreción de la insulina. (No
sirven para el tratamiento de la diabetes tipo I porque la célula β
"destruida" no va a producir insulina aunque se estimule a la misma
con estas drogas).
·
Estimulan la liberación de
Somatostatina que inhibe la secreción de Glucagon (Hormona contrarreguladora de
la insulina)
·
A largo plazo, disminuyen la
resistencia periférica a la insulina.
Efectos adversos
El principal efecto adverso es la HIPOGLICEMIA
·
La Clorpropamida (1ra generación)
produce el mayor número de casos de hipoglicemia debido a su t1/2 mas larga.
Además, esta es capaz de inducir un síndrome de secreción inapropiada de la
hormona antidiurética (HAD) y reacciones tipo disulfiram.
·
La Glibenclamida es la segunda que
produce más casos de hipoglicemia.
·
Glipizida y Glimepirida son las que
producen la menor incidencia de hipoglicemia.
Meglitinidas
Encontramos a la:
Repaglinida y Netaglinida
·
Se unen a receptores de k+ (Igual al
mecanismo de acción de las sulfonil – ureas).
·
Rápido comienzo de acción.
·
Su uso es en la Hiperglicemia
Post-prandial debido a su efecto rápido pero NO sostenido.
·
Por lo anterior, deben ser tomadas
inmediatamente antes de las comidas.
·
Hay que tener precaución con
hepatopatias porque tienen metabolismo hepático.
·
Se utilizan en combinación con las
biguanidas.
Hay que señalar la diferencia entre las drogas
hipoglicemiantes y las antihiperglicemiantes. Las primeras buscan disminuir la
glicemia, mientras que las segundas impiden que esta ascienda a niveles fuera
de lo normal (> 110 mg/dl en ayunas)
·
Biguanidas
·
Tiazolidinedionas
·
Inhibidores de la alfa glucosidasa
Biguanidas
Fenformina
Metformina
·
La Fenformina nunca se llego a utilizar
ya que producía acidosis láctica.
·
No estimulan la secreción de insulina.
·
El mecanismo de acción es poco
conocido: mejoran la sensibilidad a la insulina e inhiben la gluconeogenesis y
la absorción intestinal de glucosa, es decir, impiden el aumento de la glucosa
en sangre.
·
Son efectivas en la diabetes tipo II,
aunque a diferencia de los hipoglicemiantes, también pueden usarse en la
diabetes tipo I.
·
NO inducen Hipoglicemia.
·
Contraindicaciones: daño renal, daño
hepático, enfermedad vascular periférica, alcoholismo,
enfermedad cardiaca, enfermedad pulmonar.
Tiazilidinedionas
Troglitazona
Ciglitazona
Pioglitazona
Rosiglitazona
·
La Rosiglitazona es la más utilizada.
·
El mecanismo de acción no es bien
comprendido.
·
Mejoran la sensibilidad a la insulina
pero su efecto tarda varios días en aparecer. Aumentan la captación de glucosa
basal y la que es estimulada por insulina en el músculo y el tejido adiposo,
esto se explica porque incrementan la presencia de las proteínas transportadoras
glut-1 y glut-4.
·
Su uso es en la diabetes tipo II, pero
pueden usarse en la tipo I.
·
Son bien toleradas, NO inducen
Hipoglicemia.
·
Metabolismo hepático y excreción fecal.
Inhibidores de la alfa glucosidasa
Acarbosa
Miglitol
·
Miglitol es la más utilizada.
·
Son inhibidores competitivos de las
alfa glucosidasas, entre estas, la glucoamilasa, sucrasa, maltosa e isomaltosa
que son enzimas encargadas de degradar y convertir los carbohidratos en moléculas más simples que si pueden
absorberse.
·
Por lo anterior, entonces, impiden la
absorción de carbohidratos.
·
Su uso: como tratamiento complementario
de la diabetes mellitus .
·
Como efectos adversos, tenemos que la
presencia de mayor cantidad de azucares en el tubo digestivo fomenta el
desarrollo bacteriano, por lo que hay flatulencias, dolor abdominal y diarrea.
·
Se ha visto que incrementan las
transaminasas hepáticas.
Glucocorticoides
Sintetizados normalmente en el organismo por la corteza
suprarrenal.
Todos provienen de un precursor común, el colesterol.
Por su característica de ser lipofilicas, atraviesan todas
las membranas celulares lo que les permite una absorción completa en cualquier
lugar del organismo.
Antes de hablar de los diferentes glucocorticoides es
necesario señalar que estos también poseen cierta actividad mineralocorticoide
(retención de Na+ , agua y excreción de K+) lo que puede
acarrear alteraciones importantes en el equilibrio hidroelectrolitico del cuerpo.
Si bien existen drogas que poseen función glucocorticoide y
mineralocorticoide, existen otras que por el contrario poseen muy poca o nula
actividad mineralocorticoide, lo que se traduce en menos efectos adversos sobre
los líquidos y electrolitos.
Entre los glucocorticoides más importantes, encontramos:
- Hidrocortisona: de acción muy corta.
·
Cortisol: tiene potencia leve y
duración de acción breve.
·
Prednisona Duración de acción
·
Triamcinolona intermedia
·
Fludrocortisona: ALTA acción
mineralocorticoide (Hay que tener cuidado con los efectos adversos)
·
Betametasona y Dexametasona: tienen una
ALTA potencia antiinflamatoria, NO tienen actividad mineralocorticoide y tienen
una duración de acción larga, haciéndolas glucocorticoides de mucha utilidad.
Aspectos cinéticos
·
Absorción completa (muy lipofilicas)
·
Unión a proteínas transportadoras de
esteroides y albúminas
·
Metabolismo hepático que origina
metabolitos inactivos
·
Excreción renal
·
Vías de administración: oral, inhalada,
tópica, parenteral, ocular, rectal.
(Los inhalados de mayor potencia son en orden de menor a
mayor potencia: Fluticasona, Beclometasona, Mometasona y Triamcinolona.)
Los glucocorticoides se deben dar una vez al día: 6 – 8 p.m.
preferiblemente. (Algunos se administran en días alternos, como la prednisona)
El tratamiento, para que haga algún efecto, debe ser prolongado. En caso de
retiro del medicamento, la disminución de la dosis debe ser progresiva.
Mecanismo de acción
·
Síntesis de lipocortina, que inhibe a
la fosfolipasa A2. La fosfolipasa A2 es una enzima que se encarga de liberar al
acido araquidonico de las membranas celulares y a partir de este se sintetizan
las prostaglandinas y tromboxanos. Por esta razón, al inhibir a la fosfolipasa
A2, disminuye la síntesis de prostaglandinas que intervienen en un gran número
de mecanismos inmunológicos, como por ejemplo, el aumento de la permeabilidad
vascular y la extravasación de células inmunitarias a los tejidos.
·
·
Formación de complejos
proteína-proteína con API y NF-KB (en el núcleo celular): estos complejos son
capaces de inhibir la síntesis de citoquinas pro-inmunitarias y colagenasas.
·
Efectos anticrecimiento,
antiinflamatorio e inmunosupresor.
(Por todo esto se puede ver que los efectos de los
esteroides son generalmente tardíos)
Efectos fisiológicos y farmacológicos
·
Inhibición de la migración leucocitaria, macrófagos
principalmente, que produce aumento de los glóbulos blancos en sangre
(Neutrofilia) e inhibición de la inmunidad celular que produce disminución del
numero de linfocitos (Linfopenia).
·
Inhibición de los macrófagos, basófilos
y eosinófilos.
·
Inhibición del complemento.
·
Disminución del tamaño de ganglios y
del bazo.
·
Redistribución de la grasa que ocasiona
obesidad central.
·
Catabolismo muscular, de piel,
hueso y tejido conjuntivo.
·
Inhibición de la entrada de glucosa a
la célula. Hiperglicemia.
·
Gluconeogenesis, Lipólisis.
·
Absorción de líquidos, Na+ y excreción
de K+.
·
Maduración pulmonar en el feto.
Usos terapéuticos de los glucocorticoides
Por vía oral: terapia de reemplazo (falta de producción del
organismo); como antieméticos; en el asma; enfermedades autoinmunes; leucemias; linfomas;
distrofia muscular; síndrome nefrotico; rechazo de órganos.
Por vía oral inhalada: en el asma principalmente.
Por vía nasal inhalada: rinitis alérgica.
Por vía ocular: conjuntivitis alérgica, iritis, queratitis,
neuritis óptica,
lesión corneal.
Por vía tópica: dermatitis alérgica de contacto, dermatitis
seborreica, psoriasis.
Por vía parenteral: lesión espinal aguda, anemias, sepsis,
edema cerebral (Hipertensión endocraneana)
Por vía rectal: hemorroides, proctitis, colitis ulcerativa.
De acuerdo a la duración de la acción:
Los de acción corta: como por ejemplo la hidrocortisona, se
usan principalmente en reacciones alérgicas y anafilácticas.
Los de acción intermedia: como por ejemplo la prednisona y
la triamcinolona, se usan en trastornos inmunológicos.
Los de acción prolongada: como por ejemplo la betametasona y
dexametasona, se usan ya en trastornos muy específicos.
Efectos adversos
·
Supresión del eje Hipotalamico
hipofisiario (HHS). Al administrar continuamente glucocorticoides exógenos, no
se liberan los factores que estimulan a la ACTH para que a su vez esta estimule
la producción de glucocorticoides en la glándula suprarrenal. (>5 mg de
prednisona por mas de dos semanas produce ya: letargia, debilidad, anorexia,
nauseas, fiebre,
artralgia)
·
Inmunosupresión
·
Ulceras pépticas
·
Hipokalemia (Los de mucha acción
mineralocorticoide)
·
Miopatias
·
Calambres (Por el catabolismo muscular
y la hipokalemia)
·
Osteoporosis, que puede producir
fracturas de columna vertebral y costillas.
·
Osteonecrosis.
·
Retardo del crecimiento.
Interacciones
·
Vacunaciones, que significan un riesgo
si se inhibe la inmunidad.
·
Inhibidores metabólicos, que aumentan
las concentraciones de los glucocorticoides.
·
Estrógenos
·
Digitalicos, que potencian la
hipokalemia.
·
Diuréticos, que potencian la
hipokalemia e hiperglicemia.
·
AINES, hay mas posibilidad de ulcera
peptica.
- Bifosfonatos
- Calcio
- Vitamina D
- Calcitonina
Bifosfonatos
Son las drogas más efectivas para el tratamiento de la osteoporosis y siempre se utilizan junto a la
administración de calcio y vitamina D.
En su molécula, todos los bifosfonatos presentan dos cadenas
radicales:
R1= un grupo hidroxilo (OH) que les permite unirse
a los cristales de hidroxiapatita en el tejido óseo. Esta afinidad es bastante
fuerte y estable, por lo que sin importar la vida media, estas drogas pueden
permanecer unidas por meses e incluso años.R2= generalmente un grupo amina (NH)
que potencia la actividad antirresortiva sobre el hueso. A mayor longitud de
esta cadena radical, mayor va a ser la potencia antirresortiva de la droga.
En general, los bifosfonatos desaceleran el proceso resortivo, inhiben a los osteoclastos
(responsables de la resorción ósea) y aumentan la mineralización del hueso. Se
ha encontrado que algunos reducen la incidencia de fractura de cadera y de
cuerpos vertebrales y otros que únicamente reducen las fracturas de los cuerpos
vertebrales, lo cual debe ser tomado en cuenta al momento de elegir la droga a
administrar.
Encontramos dentro del grupo de los bifosfonatos:
·
Etidronato: Droga de 1ra generación.
Aunque es utilizada para otros fines, actualmente NO se usa para el tratamiento
de la osteoporosis, ya que esta no favorece la mineralización del hueso y
aunque aumentaba la densidad ósea, el tejido óseo era frágil y por
lo tanto muy propenso a las fracturas.
·
·
Pamidronato: de 2da generación, al
igual que la anterior, su uso es muy raro en la actualidad para tratar la
osteoporosis.
·
·
Alendronato (Fosamax®): es la droga más
utilizada para tratar la osteoporosis. Tiene uso oral.
·
Risedronato: es la segunda droga mas
utilizada, también se da por vía oral.
·
Ibandronato (Vía oral y EV)
·
Zoledronato ó Acido Zoledronico (Vía
EV)
Aspectos cinéticos de importancia
·
Todos los bifosfonatos administrados
por vía oral tienen muy baja biodisponibilidad y los alimentos disminuyen su absorción por lo que
deben darse lejos de las comidas.
·
Tienen una t1/2 aproximada de 15-60
minutos.
·
Se acumulan en el hueso.
·
Ibandronato y Zoledronato son las que
pueden administrarse por vía EV, lo que las hace inadecuadas para el
tratamiento de la osteoporosis. Sin embargo, son altamente utilizadas en las
neoplasias que producen metástasis óseas y osteoporosis intensa, como por
ejemplo, el cáncer de mama, el cáncer de próstata y el
cáncer de pulmón. Se ha encontrado que si se usan tempranamente, demoran ó
incluso impiden la destrucción ósea.
Mecanismo de acción de los bifosfonatos
Inhibición de la enzima farnesil-difosfatasa-sintetasa
(presente en la vía de la biosíntesis
del colesterol) y papel limitante en la actividad de los osteoclastos.
Indicaciones terapéuticas
·
OSTEOPOROSIS
·
Enfermedad de Paget (Etidronato)
·
Hipercalcemia por neoplasias.
·
Destrucción del hueso por neoplasias.
·
Mineralización y osificación ectopica
(Neoplasias)
- Prevención o retardo de aparición de metástasis óseas.
Efectos adversos
·
Esofagitis: es el efecto adverso que
más frecuentemente refiere el paciente y se produce con cualquier bifosfonato
dado por vía oral.
·
Desmineralización del hueso (Se observa
con Etidronato)
·
Fiebre, leucopenia, toxicidad renal (Se
observa con los bifosfonatos administrados por vía EV)
·
Irritación gástrica (Principalmente con
Pamidronato y Alendronato)
·
¿Cáncer de pulmón? Se ha citado la
mayor incidencia en pacientes que toman Risedronato.
·
Pamidronato es el mas toxico para el
riñón.
Calcio
Mineral del organismo, que en un 95% se encuentra formando
parte de la estructura de los huesos.
Cinética
Absorción: se lleva a cabo en el duodeno y en el yeyuno;
solo se absorbe el 30% del calcio ingerido. Además, este mecanismo de
transporte requiere de la forma activa de la vitamina D, por lo que es un error
administrar calcio si no hay actividad de esta vitamina.
Los alimentos favorecen la absorción y se ha visto que
durante la noche es mayor, por lo que se recomienda la mayoría de las veces que
las dosis de calcio se tomen junto a la cena.
Excreción: renal, la cual es regulada por la PTH
(Paratohormona)
Encontramos distintas presentaciones de calcio:
Vía oral: Ascorbato de calcio, Carbonato de calcio (Puede
cristalizar en riñón y estomago), cloruro de calcio, entre otros.
El Citrato de calcio es el más soluble y el que mejor se
absorbe, especialmente en riñón; además de que posee menos riesgo de producir
litiasis renal.
Vía EV: Cloruro de calcio, glubionato de calcio,
piroglutamato de calcio.
Dosis útil: 500 mg de calcio durante la cena.
Indicaciones terapéuticas
·
Hipocalcemia
·
Osteoporosis: ya que el aumento de
calcio en sangre disminuye la secreción de PTH, que es la principal
estimuladora de la resorción del hueso.
·
Osteodistrofia renal.
Vitamina D
·
Ergocalciferol (Vit. D2)
"Fitohormona", se obtiene de plantas.
·
Colecalciferol (Vit. D3)
·
Calciferol o calcidiol (25 OH D3)
"Debe aun ser activada en el riñón, por lo que no debe administrársele a
pacientes con daño renal"
·
Calcitriol (1,25 OH2 D3) "Es el de
elección para Osteoporosis"
·
Alfacalcidiol (1alfa OH D3)
Acciones Farmacológicas
·
Absorción de Calcio y Fósforo en el
intestino.
·
Mineralización ósea ( Actividad
Osteoblastica )
·
Resorción ósea ( Actividad
Osteoclastica )
·
Reabsorción renal de calcio y fósforo.
Indicaciones terapéuticas
- Hipoparatiroidismo
- Osteodistrofia renal
- Raquitismo y Osteomalacia
- Osteoporosis (Se usa Calcitriol)
Calcitonina
Humana
Salmón (20 veces más potente)
Efectos farmacológicos
·
Inhibe la resorción ósea.
·
Efecto hipocalcemiante, ya que favorece
el deposito del calcio.
·
Propiedades analgésicas.
·
Administración parenteral o nasal (La
vía parenteral suele producir muchos efectos adversos debido a la disminución
del calcio en sangre y en el músculo)
Indicaciones terapéuticas
·
Enfermedad de Paget
·
Hipercalcemia
·
Osteoporosis
·
Dolores producidos por neoplasias.
Efectos adversos
·
Molestias gastrointestinales
Enfermedades vasculares y Hormonas sexuales (Estrógenos y
Progestágenos)
Estrógenos
Naturales: Estradiol (El mas importante), Estrona, Estriol
(De uso para terapia de sustitución) y Estrógenos conjugados.
Sintéticos: Etinilestradiol, Mestranol, Quinestrol (Estos
compuestos sintéticos tienen t ½ mas largas y son mas potentes; se usan
principalmente como anticonceptivos)
No esteroideos: Dietiletilbestrol, Clorotrianiseno,
Metalenestril.
Mecanismo de acción de los estrógenos
·
Se unen a los receptores
citoplasmáticos α y β, por lo que activan el elemento de respuesta al estrσgeno
(ERE) y promueven la transcripciσn y síntesis de proteínas.
·
·
El receptor no unido tiene forma monomerica,
al unirse a la hormona forma dimeros, los cuales tienen mayor afinidad y
rapidez para unirse al DNA. El complejo DNA-Dimero recluta proteínas
coactivadoras hasta la región del promotor para activar la trascripción. Por
otra parte, la unión con un antagonista origina una conformación diferente que
une correpresores que impiden la transcripción.
·
·
Mecanismos "no genomicos" de
los estrógenos: pueden unirse a receptores de membrana y activar la vía de la
MAPkinasa, sin unirse al ERE y sin estimular la transcripción de genes y la
síntesis de proteínas, generando, entre otras, las siguientes acciones:
Producción de oxido nítrico (Estimulando la actividad de la enzima Oxido Nítrico
sintetasa independiente de la transcripción de genes); y la unión al receptor α
cardiovascular (Efecto protector).
Farmacocinética
El Estradiol se liga a SHGB (Hormona transportadora) y
albúmina; y se metaboliza a Estrona y Estriol en el hígado. Tienen una
excreción biliar con reabsorción por circulación enterohepatica de metabolitos activos (Por esta razón los compuestos
sintéticos tienen una t ½ mas larga).
La t ½ del estradiol es de pocos minutos mientras que, por
ejemplo, la
del etinilestradiol es de 13-24 horas.
Debido a que los estrógenos sufren metabolismo hepático al
ser administrados por vía oral a altas dosis (Metabolismo pre-sistémico) tienen
muchos efectos hepáticos como la síntesis de algunas proteínas y de
triglicéridos.
Efectos fisiológicos
·
Maduración sexual y crecimiento normal
de la mujer.
·
Proliferación del endometrio, aumento
del numero de receptores para progesterona y además, pueden producir
hiperplasia, razón por la cual los estrógenos nunca deben darse como drogas
únicas, ya que, pueden causar la aparición de Cáncer)
·
Aumenta la producción de moco cervical.
·
Disminución de la resorción ósea (<
Osteoclastos) y mayor formación de hueso (> Osteoblastos).
·
Cierre de la placa epifisaria (Mujeres
son de talla mas baja).
·
Proliferación de tejido adiposo.
·
Síntesis de proteínas en hígado
(Factores coagulantes y anti-coagulantes; Angiotensinogeno, a cuyo aumento se
le atribuye, en parte, la presencia de HTA en mujeres que reciben terapia
estrogenica)
·
Aumento de los Triglicéridos y las HDL,
y disminución de las LDL.
·
Aumento del colesterol y disminución de
sales biliares, por lo que la bilis es mas espesa y hay mayor riesgo de
Cálculos biliares.
·
Efectos generales sobre el SNC.
·
Vasos sanguíneos: Aumento de Oxido
nítrico y disminución de Fibras musculares lisas (Efecto protector, Menos
aterosclerosis).
·
Retención de líquidos y edema.
·
Aumento del tamaño de las mamas.
·
Hiperpigmentación areolar.
Preparados estrogénicos
Administración oral, parenteral, transdermica y local.
Oral: estrógenos equinos conjugados, estradiol (forma
micronizada) ó etinilestradiol (que no tiene metabolismo hepático por lo que la
t ½ es mas larga). Los estrógenos conjugados son menos potentes que los
sintéticos.
Parches: evitan el paso por el hígado. Tienen la ventaja de
que tienen una liberación lenta y sostenida. Generalmente se cambian 1-2 veces
a la semana.
Intramuscular: en aceite (esteres de estradiol)
Locales: óvulos, cremas vaginales.
Usos de los estrógenos
·
Hipogonadismo primario (Estrógenos
conjugados ó etinilestradiol.) Los estrógenos conjugados secuénciales ó
continuos producen menstruación.
·
Hormonoterapia Post-menopausica,
mejoran el perfil lipidico, previenen y alivian la osteoporosis, el daño
cardiovascular, la atrofia urogenital, la dificultad para concentrarse.
·
Anticoncepción. Para este fin y siempre
que la paciente tenga útero, los estrógenos deben usarse combinados con
progestagenos para disminuir la incidencia de cáncer.
·
Cáncer de Próstata: por retroalimentación negativa para LH.
Efectos Adversos
·
Dependen de la dosis
·
Carcinogenesis
·
o Adenocarcinoma de Vagina (Dietiletilbestrol)
o Anormalidades genitales en fetos.
o Sin oposición: Cáncer de Endometrio (>riesgo 5-10 veces)
o Cáncer de Mama. El riesgo aumenta 2% por año de uso, en
menos de 4 años. Si su uso es por más de 5 años hay 35% de riesgo.
o El riesgo es mayor en mujeres delgadas.
o El riesgo se elimina luego de 5 años de suspender la terapia
de restitución hormonal.
·
Aumento de los triglicéridos.
·
Migrañas.
·
Colestasis. Enfermedades de la vesícula
y vías biliares.
·
Mayor riesgo de Trombosis venosa y ACV.
·
Sangrado uterino post-menopáusico.
·
Exacerbación de la endometriosis.
·
Contraindicaciones: pacientes con
cáncer, sangrado vaginal no diagnosticado, enfermedad hepática, trastornos
tromboembólicos, várices en miembros inferiores, fumadores crónicos.
Moduladores selectivos del receptor de estrógeno.
Antiestrogenos.
La actividad de estas drogas depende del tejido en el que
actúen. A partir de esto, en algunos tejidos pueden estimular positivamente a
los receptores de estrógeno, y en otros, bloquearlos e impedir la estimulación
de genes.
Estrógenos (Agonista puro)
|
Raloxifeno
|
Tamoxifeno
|
|
Hueso
|
Agonista
|
Agonista
|
Agonista
|
Colesterol
|
Agonista
|
Agonista
|
Agonista
|
Útero
|
Agonista
|
Antagonista
|
Agonista parcial
|
Mama
|
Agonista
|
Antagonista
|
Antagonista. Por eso su uso en el
CA de mama.
|
Raloxifeno
·
Deriva del Benzotifeno.
·
Se liga a receptores α y β de estrσgeno
y bloquean la unión de estrógeno.
·
Mantiene estructura ósea: agonista
estrogenico.
·
Mejora perfil lipidico: < colesterol
< LDL > HDL. No modifica triglicéridos.
·
Inhibe la migración de células
musculares lisas.
·
< Fibrinogeno.
·
Actúa como antiestrogeno en útero y
mama.
·
No produce sangrado.
·
Produce con mayor frecuencia calambres
y trastornos tromboembolicos en miembros inferiores.
Progestágenos (Progestinas)
Con la denominación de progestágenos se incluye a un grupo
de drogas de origen sintético que tienen la propiedad común de inducir modificaciones
endometriales similares a las producidas por la progesterona. Hoy en día también
se incluyen en esta denominación drogas que tienen acciones similares a la
progesterona en varios órganos pero que en el endometrio producen
modificaciones diferentes, de tal forma que lejos de favorecer la implantación
del óvulo, la imposibilitan.
Clasificación de los progestágenos
De acuerdo a su origen y estructura química se les clasifica de la siguiente
manera:
A) Naturales
·
Progesterona
·
17 Alfa Hidroxiprogesterona
B) Sintéticos
Análogos de 21 carbonos (Derivados de la 17 alfa
progesterona)
Estos medicamentos tienen una gama de actividad muy similar
a la de la hormona endógena. Se utilizan con mayor frecuencia junto con
estrógenos para hormonoterapia de restitución en post-menopausicas, y en otras
situaciones en las cuales se desea un efecto progestacional selectivo.
·
Caproato De Hidroxiprogesterona
·
Acetato De Medroxiprogesterona
·
Acetato De Clormadinona
·
Acetato De Megestrol
Análogos de 19 carbonos (Derivados de la 19 nortestosterona)
Estos compuestos denominados "19-nor" han sido los
componentes progestagenos de los anticonceptivos orales combinados. Tienen una
actividad progestacional potente, de hecho, inhiben con mayor potencia a las
gonadotropinas, pero también muestran varias actividades androgenicas y de
otros tipos (son menos selectivos) que se cree contribuyen a sus acciones
adversas.
Un sustitutivo etinilo en C17 proporciona análogos de la
19-nor testosterona como:
·
Noretindrona
·
Noretinodrel
·
Diacetato de Etinodiol
La adición de un grupo etinilo en C13 genera a los
"Gonanos":
·
Norgestrel (Por adición de un grupo
13-etil a la Noretindrona)
·
Desogestrel
·
Gestodeno Tienen la actividad
androgenica mas baja de los progestagenos
·
Norgestimato
Un grupo Oxi en C3.
·
Linestrenol
Progestagenos de mayor actividad
androgenica
|
Noretindrona
|
Norgestrel
|
Linestrenol
|
Mecanismo de Acción de los progestágenos
Similar al de los estrógenos. Se unen a receptores
intracelulares en forma de monómeros y se fosforilan formando dímeros para
luego activar secuencias genomicas en el núcleo.
Los compuestos "19-nor" pueden unirse a los
receptores androgenicos y también a los receptores glucocorticoides y
mineralocorticoides.
Farmacocinética
Entre los naturales, destaca la Progesterona (producida por
el cuerpo lúteo y considerada la hormona protectora del embarazo),
la cual, es una precursora de andrógenos y estrógenos, tiene una t ½ de 5
minutos, se metaboliza en hígado y tiene excreción renal.
Los sintéticos (Progestinas) tienen una t ½ mas larga de
7-24 horas pero esta varia en cada uno de los distintos preparados.
Se metabolizan en hígado por oxidación, reducción y
conjugación con el ácido glucurónico y se excretan por orina fundamentalmente
conjugados y una muy pequeña fracción como molécula entera.
El Caproato de hidroxiprogesterona debe usarse solo por vía
parenteral debido a metabolismo hepático de primer paso, mientras que el
acetato de medroxiprogesterona, el acetato de megestrol y el acetato de
clormanidona son compuestos activos por vía oral y parenteral.
Los compuestos "19-nor" se absorben todos en forma
completa luego de la administración oral.
Efectos fisiológicos
·
Supresión de la contractilidad uterina
y de la menstruación.
·
Proliferación de los acinos en las
glándulas mamarias y desarrollo secretor en el endometrio. (Es la hormona que
predomina en la fase secretora del ciclo menstrual). Por esto, se puede ver
como difiere su acción en ambos tejidos, "Acción proliferativa" en el
tejido mamario y "Acción secretora" en el endometrio. La progesterona
y sus derivados inducen la transformación secretora del endometrio una vez que
este ya fue proliferado por los estrógenos, pero en el caso de los compuestos
sintéticos "19-nor", utilizados principalmente como anticonceptivos,
el resultado final es un endometrio delgado que no es apto para la implantación
del óvulo fecundado.
·
Disminución de la generación de
impulsos hipotalamicos y aumento de la amplitud de LH.
·
Aumento de la temperatura corporal a mitad del ciclo menstrual.
·
Aumento de la respuesta al CO2
·
Efecto hipnótico y depresor sobre el
SNC.
·
Estimula la actividad de las
lipoproteínas y el deposito de grasa < HDL > LDL.
·
Favorece la acción de la insulina.
Aumenta su respuesta a la glucosa y el almacenamiento de glucógeno.
·
Compite con la aldosterona y por lo
tanto disminuye la reabsorción de Na+.
Usos de los progestagenos
·
Anticoncepción. Se administran solos ó
con estrógenos en anticonceptivos orales. (Compuestos "19-nor")
·
Hormonoterapia de restitución hormonal.
Se administran combinados con estrógenos. (Hidroxiprogesterona y Acetato de
Medroxiprogesterona)
·
Dismenorrea.
·
Endometriosis.
·
Hemorragia uterina.
·
Síndrome pre-menstrual.
·
Con fines diagnósticos para probar la
secreción de estrógenos.
·
Cáncer de endometrio.
Efectos Adversos
Estos adquieren importancia cuando los progestágenos son
administrados en forma continua y por períodos de tiempo prolongado.
Los efectos adversos y las contraindicaciones específicas de
estas hormonas, principalmente los compuestos sintéticos "19-nor",
son las mismas que serán estudiadas en el grupo de las drogas anticonceptivas,
debido a que este tipo de progestagenos, en su mayoría, se encuentran formando
parte de los medicamentos utilizados con fines anticonceptivos.
Las drogas anticonceptivas están constituidas por un grupo
de hormonas semisintéticas y sintéticas que tienen como finalidad prevenir el
embarazo de forma temporal y reversible. La fertilidad es inmediata al
suspender su uso.
Estas hormonas que se utilizan en la anticoncepción son
esteroides sintéticos, tanto estrógenos como progestágenos, los cuales ya
fueron descritos en el punto anterior. La mayoría de los anticonceptivos que se
prescriben en el mundo contienen un estrógeno y un progestageno.
Tipos de anticonceptivos
Por vía oral
Combinados: contienen un estrógeno y un progestageno. Tienen
la mayor seguridad anticonceptiva.
Continuos con solo progestinas: generalmente se empiezan a
usar cuando los anticonceptivos combinados producen muchas crisis de migraña en las pacientes.
Secuénciales: el ciclo terapéutico incluye dos clases de
comprimidos: un estrógeno solo durante los primeros 14 días del ciclo, seguido
por una combinación de estrógeno-progestina en la fase final del ciclo.
Por vía parenteral
Estrógenos y Progestagenos: aplicación mensual intramuscular
de estrógenos y progestágenos de depósito con un tiempo de eficacia de unos 25 días aproximadamente.
Únicamente Progestagenos: aplicación trimestral de acetato
de medroxiprogesterona por vía intramuscular antes del día 5to del ciclo y
luego regularmente, cada 3 meses.
La administración IM tiende a causar muchas cefaleas,
nauseas y vomito.
Implantes
Hay que tener cuidado porque si pueden retardar la
fertilidad.
Post-coito
Con estrógenos solos o combinados con progestagenos. Cabe
destacar que su efecto anticonceptivo disminuye con el paso de las horas, debe
administrarse antes de las 24-48 horas después del coito y se ha demostrado que
tienen una eficacia del 97%. Estas dosis altas de estrógenos a menudo producen
reacciones adversas intensas, entre ellas, cefaleas, calambres en las piernas,
cólicos abdominales, nauseas y vomito, por lo que normalmente se reservan para
situaciones de emergencia.
Mecanismos de acción anticonceptivos
Los mecanismos anticonceptivos de las hormonas sexuales
femeninas son los siguientes:
·
Falta de ovulación: efecto inhibitorio
sobre la liberación de LH y FSH, actuando sobre hipotálamo e hipófisis. La
acción anovulatoria depende fundamentalmente del progestágeno, aunque se
potencia entre si con el componente estrogenico del anticonceptivo.
·
·
Acción endometrial: previamente se ha
indicado que los progestagenos sintéticos ("19-nor") provocan cambios
importantes en el endometrio que evitarían la implantación del blastocisto.
·
·
Alteración del moco cervical: modifican
las condiciones bioquímicas y biofísicas del moco haciéndolo hostil a los
espermatozoides.
·
·
Acción tubarica: falta de movilidad y
secreción de las trompas uterinas, lo que compromete la nutrición de las mórulas provocando muchas veces la muerte de las mismas.
Efectos adversos
En contraste con otros medicamentos que se utilizan para
tratar enfermedades, estos fármacos por lo general se emplean en una población relativamente joven y saludable, de
este modo, la consideración de posibles efectos adversos tiene importancia
especial.
Leves:
Nauseas, mastalgias, hemorragias intermenstruales, edema,
cefalea.
Moderados:
Sangrado intermitente (Spotting) con el progestageno solo,
aumento de peso, pigmentación de la piel, acne, hirsutismo, dilatación
ureteral, infecciones.
Graves:
Tromboembolismo venoso, ACV, ictericia, colecistitis,
adenomas hepáticos, cáncer de cuello uterino.
Contraindicaciones:
·
Fumadoras (Mujer fumadora mayor de 35
años no debe recibir anticonceptivos. Mucho riesgo de trombosis)
·
Enfermedades tromboembólicas.
·
Migrañas.
·
Diabetes.
·
Enfermedades hepáticas.
·
Enfermedades de la vesícula biliar.
·
Ictericia.
DESCRIBIR
PATOLOGÍAS DEL SISTEMA
ENDOCRINO APLICANDO EL PAE:
DIABETES MELLITUS
La diabetes
mellitus (DM)
es un conjunto de trastornos metabólicos, que
afecta a diferentes órganos y tejidos, dura toda la vida y se caracteriza por
un aumento de los niveles de glucosa en la sangre: hiperglucemia.
La causan varios trastornos, siendo el principal la baja producción de la hormona insulina,
secretada por las células
β de los Islotes de Langerhans del páncreas
endocrino, o por su inadecuado uso por parte del cuerpo, que repercutirá en el
metabolismo de los hidratos de carbono, lípidos y proteínas. La
diabetes mellitus y su comorbilidad constituyen actualmente la principal causa
de preocupación en salud pública.
Los síntomas principales de la diabetes mellitus
son emisión excesiva de orina (poliuria), aumento anormal de la necesidad de
comer (polifagia), incremento de la sed (polidipsia), y pérdida de peso sin razón aparente.
En ocasiones se toma como referencia estos tres síntomas (poliuria, polifagia y
polidipsia o regla de las 3 P) para poder sospechar diabetes tipo 2 ya que en
su mayoría son los más comunes en la población. La Organización Mundial de la Salud reconoce tres formas de diabetes
mellitus: tipo 1, tipo 2 y diabetes gestacional (ocurre durante el embarazo), cada una con diferentes causas y con
distinta incidencia.
Para el
año 2000,
se estimó que alrededor de 171 millones de personas eran diabéticas en el mundo
y que llegarán a 370 millones en 2030. Este padecimiento causa diversas complicaciones, dañando frecuentemente
a ojos, riñones, nervios y vasos sanguíneos. Sus complicaciones agudas
(hipoglucemia, cetoacidosis, coma hiperosmolar no cetósico) son consecuencia de
un control inadecuado de la enfermedad mientras sus complicaciones crónicas
(cardiovasculares, nefropatías, retinopatías, neuropatías y daños microvasculares)
son consecuencia del progreso de la enfermedad. El Día Mundial de la Diabetes se conmemora el 14 de noviembre.
Según
datos de la OMS, es una de la 10 principales causas de muerte en el mundo.
Las
células metabolizan la glucosa para convertirla en una forma de
energía útil; por ello el organismo necesita recibir glucosa (a través de los alimentos),
absorberla (durante la digestión) para que circule en la sangre y se distribuya
por todo el cuerpo, y que finalmente, de la sangre vaya al interior de las células para que pueda ser utilizada. Esto
último sólo ocurre bajo los efectos de la insulina, una hormona secretada por el páncreas. También es necesario considerar los
efectos del glucagón, otra hormona pancreática que eleva
los niveles de glucosa en sangre.
En
la DM (diabetes mellitus) el páncreas no produce o produce muy poca insulina
(DM Tipo I) o las células del cuerpo no responden normalmente a la insulina que
se produce (DM Tipo II).
Esto
evita o dificulta la entrada de glucosa en la célula, aumentando sus niveles en
la sangre (hiperglucemia). La hiperglucemia crónica que se
produce en la diabetes mellitus tiene un efecto tóxico que deteriora los
diferentes órganos y sistemas y puede llevar al coma y la muerte.
La
diabetes mellitus puede ocasionar complicaciones microvasculares (enfermedad de
los vasos sanguíneos finos del cuerpo, incluyendo vasos capilares) y
cardiovasculares (relativo al corazón y los vasos sanguíneos) que incrementan
sustancialmente los daños en otros órganos (riñones, ojos, corazón, nervios periféricos)
reduce la calidad de vida de las personas e incrementa la mortalidad asociada
con la enfermedad
La
diabetes mellitus es un trastorno endocrino-metabólico crónico, que afecta la función de
todos los órganos y sistemas del cuerpo, el proceso mediante el cual se dispone
del alimento como fuente energética para el organismo (metabolismo), los vasos
sanguíneos (arterias, venas y capilares) y la circulación de la sangre, el corazón, los
riñones, y el sistema nervioso (cerebro, retina, sensibilidad cutánea y
profunda, etc.).
La
diabetes mellitus puede ocasionar complicaciones
microvasculares (enfermedad de los vasos sanguíneos finos del cuerpo,
incluyendo vasos capilares) y cardiovasculares (relativo al corazón y los vasos
sanguíneos) que incrementan sustancialmente los daños en otros órganos
(riñones, ojos, corazón, nervios periféricos) reduce la calidad de vida de las
personas e incrementa la mortalidad asociada con la enfermedad
La
diabetes mellitus es un trastorno endocrino-metabólico crónico, que afecta la función de
todos los órganos y sistemas del cuerpo, el proceso mediante el cual se dispone
del alimento como fuente energética para el organismo (metabolismo), los vasos
sanguíneos (arterias, venas y capilares) y la circulación de la sangre, el
corazón, los riñones, y el sistema nervioso (cerebro, retina, sensibilidad
cutánea y profunda, etc.).
Clasificación
Actualmente existen dos clasificaciones principales. La primera,
correspondiente a la OMS, en la que sólo reconoce tres tipos de diabetes (tipo 1, tipo 2 y
gestacional) y la segunda, propuesta por la Asociación Americana de Diabetes
(ADA) en 1997. Según el Comité de expertos de la ADA, los diferentes tipos de
DM se clasifican en 4 grupos:
a) tipo 1.
b) tipo 2
c) gestacional
d) Otros tipos
Diabetes
mellitus tipo 1 (DM-1)
Este tipo de diabetes corresponde a la
llamada antiguamente Diabetes
Insulino dependiente oDiabetes
de comienzo juvenil. Se presenta en jóvenes y en adultos también pero con
menos frecuencia, no se observa producción de insulina debida a la destrucción
autoinmune de lascélulas β de los Islotes de
Langerhans del páncreas esto regulado por células T.9 y que predispone a una descompensación grave del
metabolismo llamada cetoacidosis. Es más típica en personas jóvenes (por debajo
de los 30 años), y afecta a cerca de 4,9 millones de personas en todo el mundo,
una alta prevalencia se reporta en América del Norte. Los factores
ambientales afectan a la presentaciòn de la diabetes mellitus tipo 1.
Esta clase de factores pueden ser
virus(Rubeola congenita, parotiditis y coxsackieB),que pueden provocar el
desarrollo de una destrucciòn autoinmunitaria de celulas B.Otro de los factores
podría ser la exposiciòn a la leche de vaca en lugar de la leche materna en la
lactancia (una secuencia especifica de la albùmina procedente de la leche de
vaca, puede presenter reacciòn cruzada con proteinas de los islotes)
Diabetes
mellitus tipo 2 (DM-2)
Es
un mecanismo complejo fisiológico, aquí el cuerpo sí produce insulina, pero, o
bien, no produce suficiente, o no puede aprovechar la que produce y la glucosa
no esta bien distribuida en el organismo (resistencia a la insulina), esto quiere decir que elreceptor de insulina de las células que se encargan de
facilitar la entrada de la glucosa a la propia célula están dañados.
Esta
forma es más común en personas mayores de 40 años aunque cada vez es más frecuente
que aparezca en sujetos más jóvenes, y se relaciona con la obesidad; anteriormente llamada diabetes del adulto o diabetes relacionada con la obesidad. Puede estar presente con muy pocos
síntomas durante mucho tiempo. Esta diabetes se relaciona con corticoides, por hemocromatosis.
Otros
tipos de diabetes mellitus
Otros
tipos de diabetes mellitus menores (< 6% de todos los casos diagnosticados):
Tipo 3A
Tipo 3B
Tipo 3C
Tipo 3D
Tipo 3E
Tipo 3F
Etiología
En
un principio se pensaba que el factor que predisponía para la enfermedad era un
consumo alto de hidratos de carbono de rápida absorción. Pero después se
vio que no había un aumento de las probabilidades de contraer diabetes mellitus
respecto al consumo de hidratos de carbono de asimilación lenta.
Estudios
no comprobados advierten que la diabetes tipo 1 puede ser causa de una
malformación genética, la cuál podemos llevar en nuestra vida sin darnos
cuenta. A través de un factor externo (papera, gripe, rubeola, varicela entre
otros) puede causar la aparición de la enfermedad.
Actualmente
se piensa que los factores más importantes en la aparición de una diabetes tipo
2 son, además de una posible resistencia a la insulina e intolerancia a la glucosa, el exceso de peso y la falta de ejercicio. De hecho, la
obesidad abdominal se asocia con elevados niveles de ácidos grasos libres, los
que podrían participar en la insulinorresistencia y en el daño a la célula
beta-pancreática. Para la diabetes tipo 1 priman, fundamentalmente, alguna
patología que influya en el funcionamiento del páncreas (diabetes tipo 1
fulminante).
La
actividad física mejora la administración de las reservas de azúcares del
cuerpo y actúa de reguladora de las glucemias. Las reservas de Glucógeno aumentan y se dosifican mejor cuando
el cuerpo está en forma, ya que las grasas se queman con más facilidad,
reservando más los hidratos de carbono para esfuerzo intensos o en caso de que
la actividad sea muy larga que las reservas aguanten más tiempo.
Causas
genéticas del tipo 1
Este
tipo de diabetes es causada principalmente por factores externos al organismo
que la padece, (por ejemplo ciertas infecciones virales) que pueden afectar de
forma directa o de forma indirecta mediante la generación de una reacción
autoinmunitaria.
No
obstante, existe susceptibilidad genética para padecer esta enfermedad ya que
está influenciada en especial por determinados alelos de los genes del complejo
mayor de histocompatibilidad (CMH) dentro del grupo de HLA, la clase I. En el
grupo de los HLA de clase II, afectan sobre todo varios alelos de los loci DR3
y DR4 en los que los heterocigotos DR3/DR4 son especialmente susceptibles de
padecer esta enfermedad.
Causas
genéticas del tipo 2
Las bases genéticas y moleculares de la diabetes mellitus tipo 2
siguen estando poco definidas, pero se sabe que esta enfermedad se debe en su
base a factores genéticos (concordancia en gemelos monocigóticos del 69-90%
frente al 33-50% en la diabetes mellitus tipo I y en gemelos dicigóticos de
24-40% frente al 1-14% en la diabetes mellitus tipo 1) aunque estos están
estrechamente relacionados en cuanto a su grado de expresividad con los factores
ambientales ligados al estilo de vida como pueden ser el sobrepeso, la ingesta
exagerada de alimentos, la relación de polisacáridos de absorción rápida o de
absorción lenta consumidos, la actividad física realizada o la edad.
Cuadro clínico
En
el caso de que todavía no se haya diagnosticado la DM ni comenzado su
tratamiento, o que no esté bien tratada, se pueden encontrar los siguientes
signos (derivados de un exceso de glucosa en sangre, ya sea de forma puntual o
continua):
Signos
y síntomas más frecuentes:
·
Pérdida
de peso a pesar de la polifagia. Se debe a que la glucosa no puede almacenarse
en los tejidos debido a que éstos no reciben la señal de la insulina.
·
Fatiga
o cansancio.
·
Cambios
en la agudeza visual.
Signos
y síntomas menos frecuentes:
·
Aparición
de glucosa en la orina u orina con sabor dulce.
·
Dolor
abdominal.
·
Hormigueo
o adormecimiento de manos y pies, piel seca, úlceras o heridas que cicatrizan lentamente.
·
Debilidad.
·
Cambios
de ánimo.
·
Mal
aliento
Diagnóstico
Se
basa en la medición única o continua (hasta 2 veces) de la concentración de glucosa en plasma (glucemia). La Organización Mundial de la Salud (OMS) estableció los siguientes
criterios en 1999 para establecer con precisión el
diagnóstico:
·
Síntomas
clásicos de la enfermedad (poliuria, polidipsia, polifagia y Pérdida de peso)
más una toma sanguínea casual o al azar con cifras mayores o iguales de
200mg/dl (11,1 mmol/L)
·
Medición
de glucosa en plasma (glucemia) en ayunas mayor o igual a 126mg/dl (7,0
mmol/L). "Ayuno" se define como no haber ingerido alimentos en al
menos 8 horas.
·
La prueba de tolerancia a la
glucosa oral (curva de tolerancia
a la glucosa). La medición en plasma se hace dos horas posteriores a la ingesta
de 75g de glucosa en 375 ml de agua; la prueba es positiva con cifras mayores o
iguales a 200 mg/dl (11,1 mmol/l).
Seguimiento
Además
de un estudio médico adecuado, existen exámenes de laboratorio para monitorizar
los órganos afectados en la diabetes mellitus (mediante control del nivel de
glucosa, función renal, dislipidemia, etc.:
·
Pruebas
de laboratorio de rutina de seguimiento y para monitorizar complicaciones en órganos blanco:
- Determinación de microalbuminuria en
orina de 24 horas
- Creatininemia, uremia, electrolitos
plasmáticos.
·
Revisiones
por especialistas que también ayudan a evitar complicaciones:
- Revisión del plan de alimentación
por experto en nutrición.
Este
examen ofrece un resultado muy valioso en cuanto al control del paciente con
diabetes. Su principio básico es el siguiente: la hemoglobina es una proteína que se encuentra dentro de los
glóbulos rojos de la sangre y de lo que se ocupa es del transporte de oxígeno, el cual lo toma a nivel pulmonar, y
por esta vía la lleva al resto del cuerpo pulmones hacia todas las células del
organismo. Pero esta afinidad no es precisamente nada más con el oxígeno. La
glucosa se une también a ella sin la acción de insulina.
La
misma fisiopatología de la diabetes nos indica que la glucosa se encontrará en
niveles muy elevados en sangre, por la deficiencia de insulina o por la
incapacidad de esta para poderla llevar a las células (resistencia a la insulina). Esa glucosa en exceso entra a los glóbulos rojos y se
une con moléculas de hemoglobina, glucosilándola. En sentido de proporción, a
mayor glucosa, mayor hemoglobina glucosilada o glicosilada. Aunque la hemoglobina glucosilada tiene varias fracciones (HbA1a, HbA1b,
y HbA1c) la más estable, la que tiene una unión con la glucosa más específica
es la fracción HbA1c.
El
tiempo de vida de los glóbulos rojos es aproximadamente de 120 días. Esta
medición expresa el nivel de azúcar en promedio de 2 a 3 meses atrás, por lo
que es un parámetro aceptable para seguir el control de un paciente. Por este
motivo se recomienda solicitar dicho examen tres o cuatro veces al año. Esto es
sumamente útil en el control de los pacientes, debido a que usualmente estos
mejoran su dieta en los días previos al control de la glicemia, falseando los
resultados. El valor de la hemoglobina glucosilada es una herramienta eficaz
para ver el control metabólico en los últimos meses.
.
|
HbA1c (%)
|
mg/dl
|
mmol/l
|
|
6
|
126
|
7,5
|
|
7
|
154
|
9,5
|
|
8
|
183
|
11,5
|
|
9
|
212
|
13,5
|
|
10
|
240
|
15,5
|
|
11
|
268
|
17,5
|
|
12
|
298
|
19,5
|
Conversión
de las unidades de glucemia
Las unidades de los resultados de exámenes de glucosa
en la sangre pueden presentarse en mmol/l o en mg/dl,
dependiendo del laboratorio donde se ejecuten.
Las fórmulas para la conversión de las unidades de
glucemia son:
·
de mmol/l a
mg/dl: Y (en mg/dl) = 17,5*X (en mmol/l) + 3,75
·
de mg/dl a
mmol/l: X (en mmol/l) = [ Y (en mg/dl) – 3,75] / 17,5
Tratamiento
Bomba de infusión de
insulina. Estos dispositivos sustituyen en algunos casos a las clásicas
jeringas, consiguiendo liberaciones de insulina más fisiológicas y adecuadas a
la ingesta.
Tanto
en la diabetes tipo 1 como en la tipo 2, como en la gestacional, el objetivo
del tratamiento es restaurar los niveles glucémicos normales. En la diabetes
tipo 1 y en la diabetes gestacional se aplica un tratamiento sustitutivo de
insulina o análogos de la insulina. En la diabetes tipo 2 puede aplicarse un
tratamiento sustitutivo de insulina o análogos, o bien, un tratamiento con antidiabéticos orales.
Para
determinar si el tratamiento está dando resultados adecuados se realiza una
prueba llamada hemoglobina glucosilada (HbA1c ó A1c). Una persona No-diabética
tiene una HbA1c < 6 %. El tratamiento debería acercar los resultados de
la A1c lo máximo posible a estos valores en la DM-1.
Un
amplio estudio denominado DDCT demostró que buenos resultados en la A1c durante
años reducen o incluso eliminan la aparición de complicaciones tradicionalmente
asociadas a la diabetes: insuficiencia renal crónica, retinopatía diabética, neuropatía periférica, etc.
Para
conseguir un buen control de la Diabetes Mellitus, en todos sus tipos, es
imprescindible la educación terapéutica en diabetes que impartida por
profesionales sanitarios (médicos, nutricionistas o enfermeras) persigue el adiestramiento de la
persona con Diabetes y de las personas cercanas a ella, para conseguir un buen
control de su enfermedad, modificando los hábitos que fuesen necesarios, para
el buen seguimiento del tratamiento (dieta + ejercicio físico + tratamiento
medicamentoso -si precisa-).
Intervenciones
en el estilo de vida
Los
principales factores ambientales que incrementan el riesgo de diabetes tipo 2
son la ingesta excesiva de alimentos y una forma de vida sedentaria, con el
consiguiente sobrepeso y obesidad.
Una
pérdida de peso mínima, incluso de 4 kg, con frecuencia mejora la
hiperglucemia. En la prevención de la enfermedad, una pérdida similar reduce
hasta en un 60% el riesgo.
Un
tratamiento completo de la diabetes debe incluir no solo una dieta especial
para el tratamiento de la patología y ejercicio físico moderado y habitual,
sino también un control médico constante. Asimismo conviene eliminar otros
factores de riesgo cuando aparecen al mismo tiempo, como la hipercolesterolemia.
Dieta
Mantener
una dieta especial es una de las mejores maneras que se puede tratar la
diabetes. Ya que no hay ningún tratamiento que cure la diabetes, en cuanto la
persona es diagnosticada de diabética debe empezar a mantener una dieta
adecuada. Se debe cuidar la cantidad de gramos de carbohidratos que come
durante el día, adaptándola a las necesidades de su organismo y evitando los
alimentos con índice glucémico alto. Lo que significa es que el
diabético no debe hacer muchas comidas con contenido de harina blanca. Elegir
panes y pastas hechas de harina integral es no solo mucho más saludable sino
que también va a ayudar a la persona controlar mejor la insulina que el cuerpo
produce.
En
el mercado hay productos hechos para los diabéticos, denominados “sin azúcar”.
Estos productos tienen contenidos de azúcar artificial que no tiene calorías
pero le da el sabor dulce a la comida. Se debe, no obstante, tener mucho cuidado
con estos productos, ya que "sin azúcar" (o sin carbohidratos con índice glucémico alto), no es lo mismo que "sin
carbohidratos".
La
"nutrición balanceada" es un elemento indispensable para el
tratamiento de la diabetes mellitus. Un buen régimen alimentario se caracteriza
por ser individual. Para ello se debe tener en cuenta la edad, el sexo, el
peso, la estatura, el grado de actividad física, clima en que habita, el
momento biológico que se vive (por ejemplo una mujer en embarazo, un recién
nacido, un niño en crecimiento, un adulto o un anciano), así como también la
presencia de alteraciones en el nivel de colesterol, triglicéridos o
hipertensión arterial.
Alimentos
muy convenientes
Son
los que contienen mucha agua y pueden comerse libremente. Se encuentran en la
acelga, apio, alcachofa, berenjena, berros, brócoli, calabaza, calabacín,
cebolla cabezona, pepino cohombro, coliflor, espárragos, espinacas, habichuela,
lechuga, pepinos, pimentón, rábanos, repollo, palmitos y tomate.
Alimentos
convenientes
Son
los alimentos que pueden ser consumidos por la persona diabética sin exceder la
cantidad ordenada por el nutricionista. En estos se encuentran las harinas: Arroz,
pastas, papa, yuca (mandioca), mazorca, plátano, avena, cebada, fríjol,
lenteja, garbanzo, soya, arvejas, habas, panes integrales y galletas integrales
o de soja. En las frutas son convenientes las curubas, fresas, guayabas,
mandarina, papaya, patilla, melón, piña, pitaya, pera, manzana, granadilla,
mango, maracuyá, moras, naranja, durazno, zapote, uchuvas, uvas, banano, tomate
de árbol, mamey y chirimoya.
En cuanto a los lácteos son convenientes la
leche descremada, cuajada, kumis y yogur dietético. También son saludables las
grasas de origen vegetal como el aceite de canola, de maíz, la soya, el aceite
de girasol, ajonjolí y de oliva. Las verduras como zanahoria, auyama, etc.
Alimentos
inconvenientes
Carbohidratos
simples como el azúcar, la panela, miel, melazas, chocolates, postres
endulzados con azúcar, helados, bocadillos, mermeladas, dulces en general y
gaseosas corrientes. También son inconvenientes las grasas de origen animal
como las carnes grasas, embutidos, mantequilla, crema de leche, mayonesas,
manteca, tocino de piel de pollo y quesos doble crema.
Medicamentos
·
Biguanidas. Como la metformina. Aumentan la
sensibilidad de los tejidos periféricos a la insulina, actuando como
normoglicemiante
·
Sulfonilureas. Como la clorpropamida y glibenclamida. Reducen la glucemia
intensificando la secreción de insulina. En ocasiones se utilizan en
combinación con Metformina.
·
Inhibidores de α-glucosidasa. Como la acarbosa.
Reducen el índice de digestión de los polisacáridos en el intestino delgado
proximal, disminuyendo principalmente los niveles de glucosa posprandial.
·
Tiazolidinediona. Como la pioglitazona. Incrementan la
sensibilidad del músculo, la grasa y el hígado a la insulina.
·
Insulina. Es el medicamento más efectivo para reducir la glucemia
aunque presenta hipoglucemia como complicación frecuente.
·
Agonistas del péptido similar al glucagón
tipo 1 (GLP-1). Como la exenatida. El GLP-1 es un
péptido de origen natural producido por las células L del intestino delgado,
potencia la secreción de insulina estimulada por la glucosa.
·
Agonistas de amilina. Como la pramlintida. Retarda el
vaciamiento gástrico, inhibe la producción de glucagon de una manera
dependiente de la glucosa.
·
Inhibidores de la
Di-Peptidil-Peptidasa-IV. Como la sitagliptina. Intensifican los
efectos de GLP-1.
Complicaciones
Independiente
del tipo de diabetes mellitus, un mal nivel de glucemia (azúcar en la sangre)
conduce a sufrir enfermedades agudas y enfermedades crónicas:
Complicaciones
agudas[editar · editar
fuente]
·
Estados hiperosmolares: llamados de manera coloquial "coma
diabético",
comprenden dos entidades clínicas definidas: la cetoacidosis diabética (CAD) y el coma
hiperosmolar no cetósico (CHNS).
Ambos
tiene en común –como su nombre lo dice–, la elevación patológica de la osmolaridad sérica. Esto es resultado de niveles
de glucosa sanguínea por encima de 250 mg/dL, llegando a registrarse, en casos
extremos más de 1 000 mg/dL. La elevada osmolaridad sanguínea provoca diuresis
osmótica y deshidratación, la cual pone en peligro la vida del
paciente.
La
cetoacidosis suele evolucionar rápidamente, se presenta en pacientes con DM tipo
1 y presenta acidosis metabólica; en cambio el coma hiperosmolar
evoluciona en cuestión de días, se presenta en ancianos con DM tipo 2 y no
presenta cetosis. Tienen en común su gravedad, la
presencia de deshidratación severa y alteraciones electrolíticas, el riesgo de
coma, convulsiones, insuficiencia renal aguda, choque hipovolémico,
falla orgánica múltiple y muerte.
Los
factores que los desencadenan suelen ser: errores, omisiones o ausencia de
tratamiento, infecciones agregadas -urinarias, respiratorias,
gastrointestinales-, cambios enhábitos alimenticios o de actividad física, cirugías o traumatismos, entre otros.
·
Hipoglucemia: Disminución del
nivel de glucosa en sangre por debajo de los 50 mg/dL. Puede ser consecuencia
de ejercicio físico no habitual o sobreesfuerzo, sobredosis de insulina, cambio
en el lugar habitual de inyección, ingesta insuficiente de hidratos de carbono,
diarreas o vómitos, etc.
Complicaciones
crónicas
Daño de
los pequeños vasos sanguíneos (microangiopatía)
·
Pie
diabético:
heridas difícilmente curables y la mala irrigación sanguínea de los pies, puede
conducir a laceraciones y eventualmente a la amputación de las extremidades
inferiores.
·
Daño renal Desde la nefropatía
incipiente hasta la Insuficiencia renal crónica terminal
·
Daño de los vasos sanguíneos grandes (macroangiopatía): trastorno de las
grandes Arterias. Esta enfermedad conduce a infartos, apoplejías y trastornos de la
circulación sanguínea en las piernas. En presencia simultánea de polineuropatía y a pesar de la
circulación sanguínea crítica pueden no sentirse dolores.
·
Daño cerebrovascular: causados por una inflamación en la
sangre lo que provoca un coagulo sanguineo, esto obstruye una arteria y puede
provocar necrosis en la zona afectada del cerebro.
·
Cardiopatía: Debido a que el
elevado nivel de glucosa ataca el corazón ocasionando daños y enfermedades
coronarias.
·
Dermopatía diabética: o Daños a la piel.
·
Hipertensión arterial: Debido a la cardiopatía y problemas
coronarios, consta que la hipertensión arterial y la diabetes son enfermedades
"hermanadas".
·
Enfermedad periodontal. Uno de los mecanismos para explicar la relación
entre diabetes mellitus y periodontitis sugiere que la
presencia de enfermedad periodontal puede perpetuar un estado de inflamación
crónica a nivel sistémico, que se hace patente por el incremento de proteína C
reactiva, IL-6, y altos niveles de fibrinógeno. La infección periodontal puede
elevar el estado de inflamación sistémica y exacerbar la resistencia a la
insulina.
·
·
El
nivel elevado de IL-6 y TNF-α es similar a la obesidad cuando induce o exacerba
resistencia a la insulina. La lesión periodontal es capaz de producir
alteraciones en la señalización de insulina y sensibilidad a la insulina,
probablemente debido a la elevación de TNF-α en la concentración plasmática.
La retinopatía diabética es una complicación ocular de la
diabetes, causada por el deterioro de los vasos sanguíneos que irrigan la
retina del fondo del ojo. El daño de los vasos sanguíneos de la retina puede
tener como resultado que estos sufran una fuga de fluido o sangre. Cuando la
sangre o líquido que sale de los vasos lesiona o forma tejidos fibrosos en la
retina, la imagen enviada al cerebro se hace borrosa.
La neuropatía diabética es consecuencia de la lesión
microvascular diabética que involucra los vasos sanguíneos menores que
suministra los nervios de los vasos. Los estados relativamente comunes que se
pueden asociar a neuropatía diabética incluyen tercera parálisis del nervio;
mononeuropatía; mononeuropatía múltiple; amilotrofía diabética; polineuropatía
dolor; nueropatía autonómica; y neuropatía toracoabdominal
La angiopatía diabética es una enfermedad de los vasos sanguíneos relacionada con el
curso crónico de la diabetes mellitus, la principal causa de insuficiencia
renal a nivel mundial. La angiopatía diabética se caracteriza por una
proliferación del endotelio, acúmulo de glicoproteínas en la capa íntima y
espesor de la membrana basal de los capilares y pequeños vasos sanguíneos. Ese
espesamiento causa tal reducción de flujo sanguíneo, especialmente a las
extremidades del individuo, que aparece gangrena que requiere amputación, por
lo general de los dedos del pie o el pie mismo. Ocasionalmente se requiere la
amputación del miembro entero.
La angiopatía diabética
es la principal causa de ceguera entre adultos no ancianos en los Estados
Unidos. En Cuba, la tasa de angiopatías periféricas en la población diabética
alcanzan los 19,5 por cada 100 mil habitan
El pie diabético tiene una "base etiopatogénica
neuropática", porque la causa primaria está en el daño progresivo que la
diabetes produce sobre los nervios, lo que se conoce como
"Neuropatía". Los nervios están encargados de informar sobre los
diferentes estímulos (nervios sensitivos) y de controlar a los músculos
(nervios efectores).
En
los díabéticos, la afectación de los nervios hace que se pierda la
sensibilidad, especialmente la sensibilidad dolorosa y térmica, y que los músculos
se atrofien, favoreciendo la aparición de deformidades en el pie, ya que los
músculos se insertan en los huesos, los movilizan y dan estabilidad a la
estructura ósea.
El
hecho de que una persona pierda la sensibilidad en el pie implica que si se
produce una herida, un roce excesivo, una hiperpresión de un punto determinado
o una exposición excesiva a fuentes de calor o frío no se sientan.
El
dolor es un mecanismo defensivo del organismo que incita a tomar medidas que
protejan de factores agresivos. Los diabéticos pueden sufrir heridas y no darse
cuenta. Además, la pérdida de control muscular favorece la aparición de
deformidades y éstas pueden, al mismo tiempo, favorecer roces, cambios en la
distribución de los apoyos del pie durante la marcha y, en definitiva,
predisponer a determinados puntos del pie a agresiones que, de no ser atajadas
a tiempo, pueden originar gangrena y por tanto ser necesario la amputación.
Trastornos alimenticios relacionados
Recientemente
se ha presentado un nuevo fenómeno conocido como diabulimia. En la diabulimia, al igual que en la bulimia y
anorexia, el paciente realiza actividades contraproducentes para su salud con
la finalidad de perder peso. En este caso la persona con diabulimia suele omitir o reducir las dosis de
insulina para adelgazar. La diabulimia tiene una mayor incidencia, al igual
que otros trastornos alimentarios, en adolescentes.
Cuidados de enfermería
• Adecuada
ingesta de líquidos
.• Si
existe hiponatremia se indicará restricción de líquidos.
• La
administración de vasopresina puede hacerse por vía parenteral o inhalada; el
objetivo suele ser mantener una diuresis inferior a 2000 ml diarios.
Se
les debe educar para reconocer los síntomas de sobredosificación de
vasopresina: aumento de peso, edemas, dolor abdominal e hipertensión.
En caso de ser administrada por vía
inhalatoria, si padece una rinofaringitis se puede alterar la absorción
.• Se
precisará de control y registro cuidadoso de los signos vitales, turgencia de
la piel, peso diario, ingestas y pérdidas y densidad de la orina
.• Es
importante la educación y cuidadosa información al paciente sobre la•
administración, dosis, horarios y posibles efectos secundarios de la
medicación.
Valoración•
Monitoreo
de S/V, monitoreo de arritmias e hipotensión y niveles de glucosa en sangre.
•
Educar pt y familiares sobre condición, tratamiento y posibles complicaciones
•
Garantizar un régimen de insulina de múltiples componentes o hipoglicemiantes
orales, combinados o separados, en esquemas que fomenten la normoglucemia del
paciente
.•
Rotación áreas de administracion de insulina• Fomentar un equilibrio entre el
consumo de alimentos, la actividad física y la dosis del medicamento.
•
Familiarizar al paciente con el auto monitoreo de la glucosa sanguínea (SMBG),
que remplazó a la prueba de orina como método de control.
•
Revisar diariamente los pies en busca de signos de enrojecimiento, fisuras,
ampollas, callosidades, disminución de la movilidad articular
PLAN DE CUIDADOS PARA PACIENTES DIABÉTICOS
1. VALORACIÓN
El estado emocional del paciente se valora al observar su comportamiento general (por ejemplo: depresión, ansiedad) y el lenguaje corporal (por ejemplo: evita el contacto ocular).
Se le pregunta cuál es su preocupación principal o sus temores acerca de la diabetes; esto permite valorar cualquier concepto erróneo o mala información respecto de la enfermedad. Se valora su capacidad de a funcionamiento y se le pregunta cómo resolvió situaciones difíciles en el pasado
2. DIAGNÓSTICO
Según los datos de la valoración, los principales diagnósticos de enfermería incluyen:
· Riesgo de déficit de líquidos por poliuria y deshidratación.
· Nutrición deficiente por desequilibrio de insulina, alimentos y actividad física.
· Déficit de información sobre el cuidado personal en caso de diabetes.
· Probable deficiencia en los cuidados personales por alteraciones físicas o factores sociales.
· Ansiedad por pérdida de control, temor a la incapacidad de tratar la diabetes, información equivocada sobre ésta y miedo a las complicaciones.
3. PLANIFICACIÓN (OBJETIVOS)
Los principales objetivos incluyen mantenimiento del equilibrio de líquidos y electrolitos, control adecuado de la glucemia, recuperación del peso perdido, capacidad para aprender habilidades básicas de supervivencia y de cuidado personal en caso de diabetes, reducción de la ansiedad y ausencia de complicaciones.
4. EJECUCIÓN
CONSERVACIÓN DEL EQUILIBRIO DE LÍQUIDOS Y ELECTROLITOS
Se miden los ingresos y las pérdidas de líquidos y electrolitos, que se reponen por vía intravenosa según prescripciones y se alienta el consumo oral de líquidos si está permitido. Se vigilan los datos de laboratorio de electrolitos séricos (en especial sodio y potasio), así como los signos vitales para detectar posible deshidratación (taquicardia, hipotensión ortostática).
MEJORAMIENTO DEL CONSUMO NUTRICIONAL
El objetivo principal de la dieta es controlar la glucosa, pero también debe tomarse en consideración el estilo de vida del paciente, sus antecedentes culturales, su nivel de actividad y sus preferencias en cuanto a alimentos. Se requiere de un consumo calórico adecuado si el paciente desea conseguir y mantener el peso deseado. Se le alienta a ingerir todas sus comidas y bocadillos de acuerdo con la dieta del diabético. Se consulta al dietista para incluir bocadillos extra antes de incrementar la actividad física. La enfermera debe asegurarse de que se modifiquen las dosis de insulina en caso de que ser retrase la comida debido al diagnóstico y a otros procedimientos.
REDUCCIÓN DE LA ANSIEDAD
La enfermera proporciona apoyo emocional y fija un horario para estar con el enfermo que desea manifestar sus sentimientos, quiere llorar o hacer preguntas acerca del nuevo diagnóstico. Se disipa cualquier malentendido del paciente o la familia con respecto a la diabetes. Asimismo, se les ayuda a enfocarse en el aprendizaje del cuidado personal.
Se alienta al
enfermo a realizar las actividades que más teme y se le asegura que la ansiedad
desaparece una vez que se realizan los procedimientos por primera vez, como
inyectarse o tomar las muestras para vigilancia de glucosa sanguínea. Se le
elogia cuando emprende conductas de cuidado personal, incluso si aún no domina
por completo la técnica.
MEJORAMIENTO DE LOS CUIDADOS PERSONALES
La instrucción para el paciente es la principal estrategia para que el enfermo aprenda a cuidar de sí mismo. Se utiliza equipo especial para enseñar las habilidades de supervivencia de la diabetes, como usar lupa para preparar la insulina o un aditamento auxiliar para inyectarla. Puede solicitarse a la ADA material para personas con baja escolaridad y en idiomas distintos del inglés. También la familia debe aprender, de modo que pueda ayudar en el tratamiento de la diabetes, por ejemplo, para llenar las jeringas o vigilar la glucemia.
Se consulta a un especialista en diabetes
respecto de los diversos monitores de glucosa sanguínea u otro equipo para uso
de pacientes con deficiencias físicas. Se ayuda al enfermo a que identifique
las fuentes de enseñanza de que dispone en la comunidad. También se informa a
otros miembros del personal de salud acerca de las variaciones en el horario de
las alimentos y el trabajo (por ejemplo, si el paciente trabaja de noche o por
la tarde y duerme durante el día), de manera que el régimen de tratamiento se
ajuste a las necesidades personales.
5. EVALUACIÓN FINAL
RESULTADOS ESPERADOS
Entre los resultados esperados se incluyen los siguientes:
1. Equilibrio de líquidos y electrólitos.
a. Equilibrio entre ingresos y pérdidas.
b. Valores electrolíticos dentro de límites normales.
c. Signos vitales estables al resolverse hipotensión ortostática y taquicardia.
2. Equilibrio metabólico.
a. Evitación de niveles extremos de glucosa (hipoglucemia o hiperglucemia).
b. Resolución rápida de los episodios de hipoglucemia.
c. Sin mayor pérdida de peso (en su caso) y logro del peso deseado.
3. Demostración/verbalización de las habilidades de supervivencia para la diabetes.
a. Define la diabetes como un estado en el cual se eleva la glucemia.
5. EVALUACIÓN FINAL
RESULTADOS ESPERADOS
Entre los resultados esperados se incluyen los siguientes:
1. Equilibrio de líquidos y electrólitos.
a. Equilibrio entre ingresos y pérdidas.
b. Valores electrolíticos dentro de límites normales.
c. Signos vitales estables al resolverse hipotensión ortostática y taquicardia.
2. Equilibrio metabólico.
a. Evitación de niveles extremos de glucosa (hipoglucemia o hiperglucemia).
b. Resolución rápida de los episodios de hipoglucemia.
c. Sin mayor pérdida de peso (en su caso) y logro del peso deseado.
3. Demostración/verbalización de las habilidades de supervivencia para la diabetes.
a. Define la diabetes como un estado en el cual se eleva la glucemia.
LA PANCREATITIS AGUDA (PA)
La pancreatitis
aguda (PA) es un proceso inflamatorio agudo del páncreas, desencadenado
por la activación inapropiada de losenzimas pancreáticos, con lesión tisular y respuesta
inflamatoria local, y respuesta inflamatoria y compromiso variable de otros
tejidos o sistemas orgánicos distantes.
La
pancreatitis aguda es una grave enfermedad inflamatoria, de carácter no
bacteriano que resulta de la autodigestión del páncreas por las enzimas que
secreta el propio órgano.La mayoría de los pacientes con pancreatitis aguda exhibe una evolución clínica autolimitante y relativamente libre de complicaciones mayores; pero alrededor de una quinta parte de los casos degenera en pancreatitis necrotizante, entidad de elevada morbilidad y muy alta mortalidad.
Epidemiología
La incidencia varía según
criterios diagnósticos y geográficos, 25-50 × 100.000 hab/año
·
Prevalencia: 0,5 a 1 caso/1000 hab./año.
·
Edad: Su incidencia aumenta con la edad
Patogenia:
El
páncreas normalmente secreta una gran cantidad de enzimas, entre ellas la
tripsina, la quemotripsina, las amilasas, lipasas, elastasas, carboxipeptidasa
A y B, etc. La gran mayoría de ellas son enzimas líticas que normalmente se
secretan en forma de precursores inactivos, los cuales junto con inhibidores
enzimáticos presentes en el jugo pancreático, protegen al páncreas de su
autodigestión. Los eventos iniciales patogénicos de la Pancreatitis Aguda no
están del todo aclarados. Existen evidencias de que la presencia de uno o más
de los siguientes factores, aumento de la presión intraductal en el sistema
excretor pancreático (litiasis biliar), reflujo de bilis al Wirsung,
hipertrigliceridemia aguda o preexistente, daño isquémico, disrupción de algún
conducto excretor (trauma), etc., desencadena una cascada inflamatoria que se
asocia a la activación enzimática intraglandular, con las consecuencias de daño
microvascular, trombosis, necrosis tisular, saponificación del tejido graso,
liberación de radicales libres y eventualmente gatillamiento de una respuesta
inflamatoria sistémica.
Fisiopatología
En la PA se produce una inflamación del páncreas secundaria a
la activación intraglandular de las enzimas pancreáticas. Se producen
alteraciones de la microcirculación: Vasoconstricción, estasis capilar,
disminución de la saturación de oxígeno e isquemia progresiva. Estas
anormalidades aumentan la permeabilidad vascular y producen edematización de la
glándula, y además puede producir extravasación de fluido intravascular rico en
proteínas al peritoneo.
En la PA el síndrome de respuesta inflamatoria sistémica
(SRIS) es frecuente, y probablemente sea mediado por las enzimas pancreáticas y
citocinas activadas y liberadas a la circulación desde el páncreas inflamado.
Algunos pacientes con daño pancreático grave desarrollan complicaciones
sistémicas graves, entre ellas fiebre, síndrome de distress respiratorio agudo
(SDRA), derrames pleurales, insuficiencia renal, shock, depresión del miocardio
y complicaciones metabólicas (hipocalcemia, hiperlipidemia, hiperglucemia,
hipoglucemia). En el curso de una PA, probablemente por isquemia intestinal, se
puede romper la barrera intestinal y permitir la translocación bacteriana desde
el intestino, lo que puede provocar una infección local y sistémica.
Etiología ·
En nuestro medio
la mayoría de las pancreatitis agudas son de etiología biliar; el segundo más
común factor etiológico es el alcohol.
Litiasis biliar: 40-50% de los casos. Sólo en el
20-30% de los casos se encuentra el cálculo enclavado en la papila. El barro
biliar y la microlitiasis son factores de riesgo para el
desarrollo de PA y probablemente son la causa de la mayoría de las PA
idiopáticas.
·
Alcohol: 35% de las PA. Es infrecuente en bebedores
ocasionales.
·
Postquirúrgica: En cirugía mayor cardíaca y abdominal. Alta
mortalidad (10-45%).
·
Hipertrigliceridemia: Con trigliceridemia >1000 mg/dl.
Mecanismo desconocido.
·
Fármacos: Azatioprina, valproato, estrógenos, metronidazol, pentamidina,
sulfonamidas, tetraciclinas, eritromicina, trimetropin, nitrofurantoina, diuréticos de asa,
tiazidas, metildopa, mesalamina, sulindac, paracetamol, salicilatos, cimetidina,
ranitidina, corticoides, ddI, L-asparginasa, 6-mercaptopurina, procainamida, cocaína, IECA,
·
Infecciones:
·
Traumatismo.
·
Metabólica: Hipercalcemia, insuficiencia renal.
·
Obstructiva: Obstrucción de la ampolla de Vater (tumores
periampulares, divertículo yuxtacapilar, síndrome del asa aferente, enfermedad
de Crohn (duodenal), coledococele, páncreas divisum, páncreas anular, tumor
pancreático, hipertonía del esfínter de Oddi.
·
Tóxicos: Organofosforados, veneno de escorpión.
·
Vascular: Vasculitis (LES, PAN, PTT), hipotensión, HTA
maligna, émbolos de colesterol.
·
Miscelánea: Pancreatitis hereditaria, úlcera duodenal
penetrada, hipotermia, trasplante de órganos, fibrosis quística,
quemaduras, carreras de fondo.
·
Sintomatología
·
Dolor abdominal en
barra, irradiado a espalda, intenso, de inicio rápido, calma en posición de
plegaria Mahometana y con la descompresión del tracto Gastro-Intestinal que
puede durar días
·
Náuseas y vómitos (en
90% de los casos) que persiste por varias horas. El cuadro es precedido de
ingesta copiosa de alimentos ó 2-3 días después del último trago dealcohol
·
B)
EXAMEN FÍSICO:
Suele
encontrarse taquicardia, taquipnea, a veces una respiración superficial, en
ocasiones agitación psicomotora, puede haber fiebre e ictericia. En el examen
pulmonar puede pesquizarse un derrame pleural izquierdo, y una hipoventilación
en las bases pulmonares. El examen abdominal puede encontrar una distensión
abdominal, dolor abdominal, aunque frecuentemente blando, si bien en ocasiones
se puede palpar un ocupamiento epigástrico, o signos peritoneales. Pueden
destacarse el signo de Mayo-Robson (dolor a la palpación del ángulo costo lumbar
posterior izquierdo) y el signo de Cullen (equímosis periumbilical)
LABORATORIO:
A)
AMILASA SÉRICA:
Está
elevada en el 85% de los casos. Puede ser normal porque su elevación es fugaz y
el examen se toma tarde, si existen niveles de triglicéridos muy elevados o si
se trata de una P.A. crónica recurrente con insuficiencia pancreática. No es
específica. Puede estar elevada en otros cuadros intraabdominales: colecistitis
aguda, coledocolitiasis, úlcera perforada, accidente vascular mesentérico,
etc.).
B)
AMILASA URINARIA:
Su
elevación es más persistente que la amilasa sérica (7-10 días). Se suele pedir
mediciones en orina de 24 hrs. Es más sensible que la amilasa sérica.
C)
AMILASA EN LÍQUIDO PERITONEAL O PLEURAL:
Su
especificidad es similar a la amilasa sérica.
D)
LIPASA SÉRICA:
Es
de gran utilidad porque es más específica y su elevación es más prolongada que
aquélla de la amilasa sérica.
E)
CALCIO SÉRICO:
Un
elemento indirecto es la presencia de hipocalcemia.
F)
EXÁMENES GENERALES:
Para
evaluar compromiso sistémico de la enfermedad y determinar su pronóstico:
Hemograma, glicemia, pruebas de función renal, pruebas hepáticas, gases
arteriales, etc.
ESTUDIO
DE IMÁGENES:
A)
RADIOLOGÍA CONVENCIONAL:
La
Rx simple de abdómen es útil realizarla en el momento del ingreso para orientar
en el diagnóstico diferencial de otros cuadros agudos abdominales. Puede
mostrar el signo del "asa centinela" en el hipocondrio izquierdo y
signos de íleo. La Rx tórax puede mostrar atelectasias basales, elevación del
diafragma y un derrame pleural izquierdo.
B)
ECOGRAFÍA ABDOMINAL:
La
visualización de la glándula pancreática no es fácil. Las formas «edematosas»
suelen verse mejor. Su utilidad radica en la evaluación y diagnóstico de la
patología biliar asociada y en el seguimiento de algunas de sus complicaciones
(pseudoquiste, colecciones, etc.). Un examen negativo no excluye el diagnóstico
de P.A.
C)
TOMOGRAFÍA AXIAL COMPUTARIZADA:
Es
el método de imágenes de mejor rendimiento en el diagnóstico de P.A. y en el
seguimiento de su evolución. Entrega información anatómica y puede tener un
valor pronóstico (Criterios de Balthazar- Ranson).
D)
COLANGIOPANCREATOGRAFÍA RETRÓGRADA (CPRE):
Su
principal valor es en las etapas iniciales de una P.A. biliar en que puede
cambiar la evolución de la enfermedad. Más controvertida es su indicación y
papilotomía en P.A. no biliares. Puede tener más complicaciones que en otras
indicaciones. También es útil en el tratamiento de algunas complicaciones de la
P.A.: pseudoquistes pancreáticos.
Diagnóstico diferencial
El diagnóstico
lo establece un cuadro de dolor abdominal (que no tiene patrón patognomónico)
acompañado de elevados niveles de amilasemia y amilasuria. El mejor método
diagnóstico disponible en la actualidad es la tomografía axial computadorizada.
Embarazo
ectópico
·
Obstrucción intestinal
·
Aneurisma disecante de aorta
·
Hereditaria (parientes que pueden haber tenido algún episodio
de esta enfermedad)
·
Pronóstico
El pronóstico, del que dependerá la actitud terapéutica, se
valora con varias escalas clínicas. La más utilizada en la actualidad son los criterios de Ranson, que se
cuantifican en el momento del ingreso y a las 48 horas.
En el momento del ingreso:
·
Edad (>55 años)
·
Leucocitosis >16.000/mm3
·
Hiperglicemia >200 mg/dL
·
LDH >400 UI/L
·
GOT >250 UI/L
A las 48h:
·
Disminución del hematocrito >10%
·
Déficit de líquidos > 4L
·
Calcio <8 mg/dL
·
PO2 <60 mmHg
·
Aumento del BUN >5mg/dL
·
Albúmina <3,2 g/dL
Tratamiento
A)
ASPECTOS BÁSICOS:
El
tratamiento de la P.A. es fundamentalmente médico y espectante en aquellos
pacientes con formas leves de la enfermedad y que no presenten complicaciones
graves. No se dispone de medicamentos específicos para esta enfermedad. La
cirugía se reserva para el tratamiento de algunas de sus complicaciones y
eventualmente para intentar cambiar el curso de la enfermedad en aquellas
formas más graves de la P.A.
B)
TRATAMIENTO MÉDICO:
- Alivio
del dolor: No usar morfina. Usar demerol u otro.
- Reposición
adecuada del volumen.
- "Reposo
pancreático": Inhibir secreción gástrica con bloqueadores H2 o
inhibidores de la bomba de protones. Uso eventual de sonda nasogástrica.
Ayuno por boca.
- Eventual
uso de somatostatina. (En protocolos de estudio)
- Nutrición
Parenteral y/o eventualmente Enteral.
- Monitorización
de la volemia (débito urinario, PVC), de la función cardiovascular,
respiratoria y renal. Vigilar criterios pronósticos y signos de
complicaciones e infección.
- Eventual
hospitalización en Unidades de cuidados especiales: Intermedio, UCI.
- El
uso de antibióticos profilácticos es aún discutido. Pueden ser indicados
específicamente en las P.A. biliares. Ante la hipótesis de infección de la
necrosis pancreática, tomar hemocultivos, eventual punción bajo TAC de la
necrosis e iniciar tratamiento antibiótico (Infección por traslocación
bacteriana).
C)
TRATAMIENTO QUIRÚRGICO:
Sus
indicaciones son básicamente 2:- Corrección
de la patología biliar asociada. En este punto actualmente la CPRE ha ganado
indiscutiblemente su indicación. Cuando se trata de resolver la litiasis o
microlitiasis vesicular se prefiere una cirugía diferida luego del
episodio de P.A.
- Tratamiento
de complicaciones locales:
Necrosis
infectada:
Necrosectomías
y drenajes asociado o no a lavado retroperitoneal o laparostomías.Absceso pancreático: drenaje quirúrgico o, cada vez más frecuente, drenaje percutáneo con técnicas de radiología intervencionista.
Pseudoquiste
pancreático:
Representa
la evolución de una P.A. tipo necrohemorrágica sin infección de la necrosis.
Muchos se resuelven espontáneamente. Aquellos llamados pseudoquistes verdaderos
(con alguna comunicación al sistema excretor pancreático) deben ser drenados ya
sea percutáneamente, vía endoscópica o por vía quirúrgica realizándose un
drenaje interno al estómago o al yeyuno por medio de un asa desfuncionalizada
en "Y de Roux".Existen algunos procedimientos quirúrgicos que tienen indicaciones limitadas y cuya efectividad ha sido discutida. Sin embargo, en grupos de pacientes estos procedimientos han sido de beneficio. Entre estos se cuentan:
El
lavado peritoneal precoz:
Su
utilidad se mostró en la fase precoz de la P.A. de curso grave, disminuyendo
las complicaciones cardiovasculares y respiratorias (Distress), sin embargo la
mortalidad no cambió.
El
drenaje del conducto torácico:
Misma
indicación que el lavado peritoneal, también útil en la fase precoz de la P.A.
La
cirugía resectiva precoz (pancreatectomía subtotal y necrosectomía):
Preconizada
por algunos autores para modificar la evolución de la P.A. de curso grave, que
debe estar reservada para centros de referencia dada su potencial alta
morbilidad. Su indicación ha sido polémica, sin embargo en aquellos pacientes
con las formas más graves de la enfermedad (7 o más criterios de Ranson),
pudieran beneficiarse de esta conducta dada su alta mortalidad aún actualmente
pese a los avances en el apoyo de UCI, nutricional, etc.
Tratamiento
El tratamiento de la pancreatitis aguda consiste en:
- Suspensión de
vía oral y, en los casos que presentan vómito, instauración de succión
nasogástrica.
- Reemplazo de
líquidos mediante infusión intravenosa de volúmenes de soluciones salinas
y dextrosa para mantener un adecuado volumen urinario (>50 ml/hora en
el adulto).
- Oxígeno por máscara
o cánula nasal, por cuanto alrededor de un tercio de los pacientes exhibe
hipoxemia de significación.
- Nutrición
parenteral, la cual al tiempo que provee el soporte necesario, evita la
estimulación de la secreción pancreática.
- Los
antibióticos profilácticos sólo se utilizan en los pacientes con
pancreatitis severa (alto índice de Ranson), en un esfuerzo por prevenir
la sepsis pancreática tardía.
El tratamiento quirúrgico en general está
contraindicado en la pancreatitis aguda, y sólo se emplea en el manejo de
complicaciones severas.
Dependerá de la gravedad del cuadro (más o menos de 3
criterios de Ranson). En los casos leves se llevarán a cabo medidas de soporte
(fundamentalmente control del dolor con meperidina, y dieta absoluta). En el
caso de que sea grave, además de las medidas citadas, se colocará una sonda
naso-yeyunal y se valorarán las siguientes medidas:
·
Antibioterapia: No
se utiliza en todos los casos. Imipenem en caso de infección de necrosis
pancreática.
·
Papilotomía por CPRE: en caso de sospecha de causa
litiásica.
·
Tratamiento quirúrgico si existe necrosis pancreática infectada
o no infectada pero con síndrome compartimental.
·
Evolución
y Complicaciones:
Las
complicaciones de la P.A. se pueden clasificar en sistémicas y locales y suelen
presentarse en 3 fases: una fase temprana o precoz (hasta el 4° día), una fase
intermedia (5° día hasta la segunda semana) y una fase tardía (desde la 3°
semana). En general las complicaciones sistémicas ocurren en la primera fase de
la enfermedad, en cambio las complicaciones locales se presentan en las fases
intermedias y tardía de la enfermedad.
A)
COMPLICACIONES SISTÉMICAS:
La
liberación de citoquinas, enzimas pancreáticas y radicales libres inician una
respuesta inflamatoria sistémica, con una importante hipovolemia secundaria a
los vómitos y particularmente al gran 3° espacio en el retroperitoneo y cavidad
abdominal. Esto puede conducir a una falla cardiocirculatoria con hipotensión y
shock, insuficiencia respiratoria, insuficiencia renal y falla multiorgánica
(FMO). Otras complicaciones sistémicas son las hemorragias digestivas, las
alteraciones de la coagulación y el íleo paralítico.
B)
COMPLICACIONES LOCALES:
Estas
corresponden a las complicaciones en el espacio retroperitoneal y cavidad
abdominal. Ellas son: la obstrucción duodenal, la obstrucción de la vía biliar,
y en particular las complicaciones de la necrosis pancreática. Una vez
instalada la necrosis pancreática y peri pancreática ella puede evolucionar
como una necrosis estéril (antiguo flemón pancreático), que se resolverá hacia
el pseudoquiste de páncreas o a la resolución espontánea. Una grave
complicación es la infección de la necrosis (necrosis infectada), que suele
llevar al paciente a una sepsis y FMO o en ocasiones a un absceso pancreático
que deberá ser drenado. Otras complicaciones locales son las hemorragias
retroperitoneales, las colecciones peripancreáticas agudas, la trombosis de la
vena esplénica, la trombosis portal, la necrosis del colon transverso, la
fístula pancreática, etc.
·
Síndrome de dificultad respiratoria aguda (SDRA)
·
Quistes o abscesos en el páncreas
·
Presión arterial baja.
PANCREATITIS CRONICA
¿Para qué sirve el páncreas? El páncreas es un órgano localizado en el
abdomen por detrás del estómago. Tiene dos tipos de función:
a) Endócrina, es decir, secreción de
sustancias que van a la sangre, llamadas hormonas, como la insulina.
b) Exócrina, es decir,
secreción de sustancias que van hacia el tubo digestivo, llamadas enzimas
digestivas, que se encargan de dividir a las proteínas, carbohidratos y grasas
en moléculas más pequeñas para que se puedan absorber en el intestino. El
páncreas tiene un conducto por el que salen las enzimas al intestino (duodeno)
y que está estrechamente conectado con otro conducto, llamado colédoco, por
donde pasa la bilis proveniente de la vesícula y del hígado.
La pancreatitis crónica es una inflamación progresiva del páncreas, que da lugar a su destrucción, provocando la pérdida de sus
funciones principales: alteración de la absorción de los alimentos (malabsorción) y aumento de los niveles de azúcar en sangre (diabetes
mellitus)
La
pancreatitis crónica es una inflamación del páncreas que no se cura o mejora o
que empeora con el tiempo y conduce a un daño permanente.
La
pancreatitis crónica, como la pancreatitis aguda, ocurre cuando las enzimas digestivas
atacan el páncreas y los tejidos circundantes, causando episodios de dolor. La
pancreatitis crónica se desarrolla a menudo en las personas que están entre las
edades de 30 y 40 años.
Etiología
La causa más frecuente es la ingesta de mucho alcohol la cual
da lugar al 70 a 90% de los casos. En un 10 a 30% de las pancreatitis crónicas
no se conoce la causa (es lo que se llama pancreatitis crónica idiopática). Una pequeña parte
de los casos de pancreatitis crónica tienen relación familiar (pancreatitis
crónica hereditaria). También se ha
relacionado con el aumento de los niveles de calcio o de triglicéridos en la sangre. En los niños, la causa más frecuente es la fibrosis quística.
La
Ingestion crónica de alcohol por muchos
años la produce con mayor rapidez. . La forma crónica de pancreatitis puede ser
provocada por un ataque agudo que daña el conducto pancreático. El conducto
dañado hace que el páncreas se inflama. El tejido cicatricial se desarrolla y
el páncreas se destruyen lentamente.
Otras
causas de la pancreatitis crónica son:
·
Trastornos
hereditarios del páncreas
·
Fibrosis
quística
·
Niveles
elevados de calcio en la sangre (Hipercalcemia)
·
Algunos
medicamentos
·
Ciertas
afecciones autoinmunes
·
Causas
desconocidas
Pancreatitis
hereditaria se puede presentar en una persona menor de 30 años de edad, pero
podría no ser diagnosticada durante varios años. Los episodios de dolor
abdominal y diarrea que dura varios días vienen y se van con el tiempo y puede
progresar a la pancreatitis crónica. Un diagnóstico de la pancreatitis
hereditaria es probable si la persona tiene dos o más familiares con
pancreatitis en más de una generación.
Clínica
La pancreatitis crónica se caracteriza por ataques
recurrentes de dolor abdominal superior y dorsalgia intensos, acompañados de vómitos. Conforme avance la
enfermedad los ataques recurrentes de dolor son cada vez más intensos,
frecuentes y prolongados.
La disminución de peso es un problema de importancia en la
pancreatitis crónica y más del 75% de los pacientes baja de peso de forma
considerable, por lo regular a causa de un menor consumo de alimentos por
anorexia o por temor de que precipiten otro ataque.
La digestión se trastorna, en especial la de proteínas y
grasas; las defecaciones se vuelven frecuentes, con heces espumosas y de olor
desagradable a raíz de trastornos de la digestión de las grasas que se traducen
en un alto contenido de éstas en la materia fecal (esteatorrea).
En casos avanzados podemos encontrar un aumento de los
niveles de azúcar en sangre debido a la disminución de los niveles de insulina
producidas por el páncreas, lo cual da lugar a una diabetes mellitus.
La mayoría de las personas con
pancreatitis crónica refiere dolor abdominal superior, aunque algunas
personas no tienen dolor en absoluto. El dolor puede irradiarse a la espalda,
se siente peor cuando come o bebe, y se vuelve constante e incapacitante. En
algunos casos, el dolor abdominal desaparece a medida que la condición
empeora.
Otros síntomas incluyen:
Otros síntomas incluyen:
·
náusea
·
vómitos
·
la pérdida de peso
·
diarrea
·
deposiciones aceitosas
Las personas con pancreatitis crónica a
menudo pierden peso, incluso cuando su apetito y hábitos alimenticios son
normales. La pérdida de peso se produce porque el cuerpo no segrega suficientes
enzimas pancreáticas para digerir los alimentos, por lo que los nutrientes no
se absorben normalmente. La digestión pobre conduce a la desnutrición debido a
la excreción de grasa en las heces.
Diagnostico
El diagnóstico de la pancreatitis crónica es difícil. Los
análisis de sangre habitualmente no son útiles. Las pruebas diagnósticas más
importantes son las de imagen. La presencia de calcificaciones pancreáticas en
una radiografía simple de abdomen es diagnóstico de pancreatitis crónica pero
lo más frecuente es que no se vean.
Existen muchas otras pruebas de imagen que nos permiten
llegar al diagnóstico: ecografía, tomografía axial computarizada y resonancia
magnética del abdomen, endoscopia digestiva con inyección de contraste en el
páncreas (colangiopancreatografía
retrógrada endoscópica o CPRE) o ecografía a
través de endoscopia digestiva (ecoendoscopia). Existen otras
pruebas que sirven para medir la capacidad de funcionamiento del páncreas.
La
pancreatitis crónica es a menudo confundida con pancreatitis aguda porque los
síntomas son similares. Al igual que con pancreatitis aguda, el médico
realizará una historia médica completa y un examen físico. Los exámenes de
sangre pueden ayudar al médico a saber si el páncreas sigue produciendo
suficientes enzimas digestivas, pero a veces estas enzimas parecen normales en
los exámenes de laboratorio aun cuando la persona tiene pancreatitis
crónica.
En
etapas más avanzadas de la pancreatitis, cuando la malabsorción y la diabetes pueden ocurrir, el médico puede
ordenar exámenes de sangre, orina y heces para ayudar a diagnosticar la
pancreatitis crónica y el seguimiento de su evolución.
Después de ordenar radiografías del abdomen, el médico llevará a cabo una o más de las pruebas utilizadas para el diagnóstico de pancreatitis aguda, ecografía abdominal, tomografía computarizada, la USE y CPRM.
Tratamiento
El tratamiento de la pancreatitis crónica puede requerir
hospitalización para el tratamiento del dolor, brindar hidratación
intravenosa y apoyo nutricional. Alimentación nasogástrica puede ser necesaria por
varias semanas si la persona continúa perdiendo peso.
Cuando una dieta normal se reanuda, el médico puede prescribir
enzimas pancreáticas sintéticas si el páncreas no segrega suficiente por sí
misma. Las enzimas se deben tomar con cada comida para ayudar a digerir la
comida y recuperar algo de peso.
El siguiente paso es planear una dieta nutritiva, baja en
grasa que incluye comidas pequeñas y frecuentes. Un dietista puede
ayudarle a desarrollar un plan de comidas. Beber mucho líquido y limitar las
bebidas con cafeína también es importante.
Las personas con pancreatitis crónica no deben fumar ni consumir bebidas alcohólicas, incluso si la pancreatitis es leve o en las primeras etapas.
Las personas con pancreatitis crónica no deben fumar ni consumir bebidas alcohólicas, incluso si la pancreatitis es leve o en las primeras etapas.
el pronóstico de la pancreatitis crónica? Una vez que el páncreas ha
perdido su función, el daño del páncreas no es reversible. El paciente deberá
continuar con medicamentos y dieta.
¿Se opera la pancreatitis crónica? En ocasiones se debe
intervenir al paciente por vía endoscópica para colocar catéteres que liberen
la obstrucción de los conductos. En algunos casos es necesario realizar cirugía
pancreática, sobre todo cuando hay dolor insoportable. En casos extremos puede
ser necesario resecar completamente el órgano.
Complicaciones
Las personas con pancreatitis crónica que siguen consumiendo grandes cantidades de alcohol pueden desarrollar episodios súbitos de dolor abdominal severo.
Al igual
que con pancreatitis aguda, la CPRE se utiliza para identificar y tratar las
complicaciones asociadas a la pancreatitis crónica, como cálculos biliares, pseudoquistes, y el estrechamiento u
obstrucción de los conductos.
Pancreatitis
crónica también puede conducir a la calcificación del páncreas, lo que significa
que el tejido pancreático se endurece a partir de depósitos de sales de calcio
insolubles. La cirugía puede ser necesaria para retirar una parte del
páncreas.
En los
casos de dolor persistente, la cirugía u otros procedimientos se recomiendan a
veces para bloquear los nervios en el área abdominal que causa el dolor.
Cuando
el tejido pancreático se destruye en la pancreatitis crónica y las células
productoras de insulina del páncreas, llamadas células beta, han sufrido daños, la diabetes se puede desarrollar. Las personas con
una historia familiar de diabetes son más propensas a desarrollar la
enfermedad. Si se produce la diabetes, la insulina u otros medicamentos son necesarios
para mantener la glucosa en sangre en niveles normales.
Un
proveedor de atención de salud trabaja con el paciente para desarrollar un
régimen de medicación, la dieta y la monitorización frecuente de la glucemia.
HIPERTIROIDISMO
El hipertiroidismo, o enfermedad de tiroides
hiperactiva, significa que la glándula tiroides produce y libera demasiada
hormona tiroidea. La glándula tiroides está ubicada en la parte frontal del
cuello, justo debajo de la nuez de Adán. Produce hormonas que controlan el
metabolismo. El metabolismo es el ritmo de los procesos del cuerpo e incluye
factores como la frecuencia cardíaca y la rapidez con que usted quema calorías.
El hipertiroidismo puede afectar su
metabolismo. También puede provocar nerviosismo, aumento de la transpiración
(sudoración), latidos cardíacos rápidos, temblores en las manos, dificultades
para dormir y pérdida de peso.
El hipertiroidismo es un tipo de tirotoxicosis caracterizado por un trastorno metabólico en el que el exceso de función de laglándula tiroides conlleva una hipersecreción de hormonas tiroideas (tiroxina (T4) libre o de triyodotironina (T3) libre, o ambas) y niveles plasmáticos anormalmente
elevados de dichas hormonas. Como consecuencia
aparecen síntomas tales comotaquicardia, pérdida
de peso, nerviosismo y temblores.
En los seres humanos, las principales causas de este
padecimiento son la enfermedad de Graves o bocio tóxico difuso (etiología más común con 70–80%), el adenoma tiroideo tóxico, el bocio multinodular tóxico, la tiroiditis subaguda y los efectos de algunos medicamentos. Se diferencia del síndrome de tirotoxicosis o tormenta tiroidea porque en esta última hay una
exacerbación del hipertiroidismo, a tal grado que pone en peligro la vida del
paciente, fundamentalmente por insuficiencia cardíaca.
Por su parte, la
tirotoxicosis engloba al hipertiroidismo y a otras enfermedades que cursan con
una elevada concentración de hormonas tiroideas, causada por la glándula
tiroidea o no.
El diagnóstico y tratamiento adecuado del hipertiroidismo
depende del reconocimiento de los signos y síntomas de la enfermedad y la
determinación de la etiología. El estudio
diagnóstico comienza determinando los niveles de la hormona estimulante de la tiroides (TSH). Cuando los resultados de la prueba son inciertos, la
medición de la absorción
de radionucleidos ayuda a distinguir entre las posibles causas. Cuando la
tiroiditis es la causante, el tratamiento sintomático por lo general es
suficiente porque el hipertiroidismo en este caso suele ser transitorio. La
enfermedad de Graves, bocio tóxico multinodular y el adenoma tóxico puede
tratarse con yodo
radiactivo, medicamentos antitiroideos o cirugía. La tiroidectomía es una opción cuando otros tratamientos han fallado o están
contraindicados, o cuando un bocio está causando síntomas compresivos. Algunas nuevas terapias
están bajo investigación. Se debe considerar tratamientos especiales en
pacientes que están embarazadas o amamantando, así como los que cursan con
oftalmopatía de Graves o hipertiroidismo inducido por amiodarona.
Fisiopatología
El exceso de hormonas tiroideas induce un aumento global del
metabolismo, con una elevación del gasto energético, de la producción de calor y consumo de oxígeno. Aumenta la síntesis
proteica, pero en conjunto predomina el catabolismo sobre el anabolismo, por lo que se
produce un balance nitrogenado negativo. Además aumenta la sensibilidad de los
tejidos a la acción de las catecolaminas, probablemente
debido a una potenciación de los receptores adrenérgicos.
Debido al efecto catabólico se produce adelgazamiento (poco
notable en la polifagia). La piel se hace
fina, aumenta la caída del cabello, las uñas se vuelven frágiles y tienden a separarse del lecho ungueal (uñas de Plummer).
El exceso de hormonas tiroideas produce un aumento de la
motilidad intestinal por lo que aumentan el número de evacuaciones. Se
sobrecarga el aparato cardiovascular debido al aumento de las necesidades tisulares de nutrientes
de oxígeno, a la necesidad de disipar el exceso de calor producido y la
hipersensibilidad cardiaca a las catecolaminas.
Aumenta la frecuencia cardiaca y pueden aparecer arritmias. En el sistema
neuromuscular el exceso de hormonas tiroideas se manifiesta con nerviosismo, irritabilidad,insomnio, trastornos mentales
que pueden oscilar desde la ansiedad al delirio, temblor fino
distal, hiperreflexia y debilidad de los músculos de la cintura.
A veces se produce disnea provocada por el consumo de oxígeno y por la ansiedad. Debe diferenciarse
de la disnea que puede provocar un bocio voluminoso al estrechar la vía
respiratoria.
Clasificación
El exceso de HT se debe a una enfermedad primaria del
tiroides, con lo que estas se elevan en sangre y suprimen la producción de TSH.
Las enfermedades pueden ser:
1.
Enfermedad de
Graves-Basedow: se trata de una enfermedad de etiología autoinmunitaria en
la que se producen inmunoglobulinas contra el receptor de la TSH que estimula
la producción de HT y el crecimiento difuso del tiroides. La gammagrafía
tiroidea demuestra la existencia de un bocio con captación difusa. Se desconoce
qué desencadena la aparición de estos anticuerpos, aunque existe una propensión
familiar. La enfermedad se manifiesta con exoftalmos, dermopatía infiltrante o
mixedema pretibial.
2.
Adenoma tiroideo tóxico: Es
un tumor benigno del tiroides que se manifiesta como un nódulo único que
produce HT en exceso. El resto de la tiroides se atrofia al suprimirse la
producción de TSH, la gammagrafía tiroidea muestra la presencia de un nódulo
mientras que el resto de la tiroides no capta yodo.
3.
Bocio multinodular
tóxico o
enfermedad de Plummer: se debe a un crecimiento policlonal de células tiroideas
que se manifiesta con múltiples nódulos de diferente tamaño, consistencia y
actividad. La gammagrafía tiroidea muestra numerosas áreas con captación
variable
4.
Tiroiditis: se puede producir
una tirotoxicosis por una brusca destrucción de la tiroides con la salida de
las HT almacenada a la sangre, el tiroides inflamado no capta yodo radioactivo
o lo capta escasamente.
5.
Hipertiroidismo inducido por yodo:
enfermedad de Jod-Basedow. Aparece al administrar yodo a pacientes con bocio
multinodular cuya producción de HT era baja precisamente por la falta de yodo.
Hipertiroidismo
secundario
El
hipertiroidismo secundario se produce por el exceso de TSH por adenomas
hipofisiarios productores de TSH (muy infrecuente).
·
El Hipertiroidismo por gonadotropina coriónica aparecen por
tumores trofoblásticos, como el coriocarcinoma, y producen enormes
cantidades de esta hormona, molecularmente emparentada con la TSH, que puede
activar el receptor tiroideo normal de la TSH.
·
Tirotoxicosis por secreción ectópica de hormonas tiroideas,
puede verse en el rarísimo struma ovárico (teratoma
ovárico que tiene tejido tiroídeo funcional).
·
Tirotoxicosis por ingestión de hormonas tiroideas en exceso,
por lo general, un efecto buscado por el profesional de salud, aunque puede
deberse a error en la dosis o a la ingestión de hormonas tiroideas con fines
manipulativos.
Cuadro clínico
La persona por lo general tiene un aumento en el metabolismo
basal, y consecuente disminución de peso, estado de gran excitabilidad, aumento
de la sudoración, debilidad muscular,
incapacidad para conciliar el sueño, intolerancia al
calor. En muchas ocasiones se observa una protrusión de los globos oculares que
se conoce como exoftalmos. El hipertiroidismo
también puede ser causa de un adenoma tiroideo.
Otros signos de aviso son nerviosismo, hiperactividad,
inquietud, desasosiego, susceptibilidad (afectan hechos que no son importantes,
ganas de llorar, cambio de carácter fácil), dolores musculares, diarrea o irritabilidad, mirada brillante, cansancio y los más
frecuentes como datos clínicos: taquicardia y palpitaciones.
Las principales características clínicas de este padecimiento
en los seres humanos son:
·
Gastrointestinales: pérdida de peso, hiperfagia (aumento
desmesurado del apetito), dolor y/o calambres intestinales, náuseas, vómitos.
·
Piel y pelo: intolerancia al calor, pelo fino y
quebradizo, perdida de cabello, aumento de la pigmentación, piel caliente o
enrojecida.
·
Psicológicos: ansiedad, nerviosismo, irritabilidad, insomnio y
despertar precoz, problemas de concentración, disminución del umbral del estrés.
·
Sexuales/reproductivos: oligorrea o amenorrea (disminución
de la cantidad de sangrado o falta total de la menstruación), disminución total o
parcial de la libido.
·
Oculares: exoftalmos, retracción del párpado
superior, edema
periorbitario, diplopía, enrojecimiento de la conjuntiva, bocio (tiroides
visiblemente agrandada) o nódulos tiroideos .
La semiología típica de este síndrome hormonal es variable, ya que depende
del individuo que lo padece y del grado de afectación sistémica de esta
patología (duración, evolución, detección precoz, etc.). En los pacientes
mayores, estos síntomas clásicos podrían no presentarse y darse sólo fatiga y
pérdida de peso, que conduce al llamado hipertiroidismo apático. En los
niños se produce un retardo de maduración ósea, por lo que tienden a ser de
talla baja.
En cuanto a otros trastornos autoinmunitarios asociados a tirotoxicosis, se ha establecido
una relación entre la enfermedad tiroidea y la miastenia
grave.
En este caso, la enfermedad tiroidea es frecuentemente una enfermedad autoinmune que aparece aproximadamente en un 5 por ciento de los
pacientes con miastenia
grave.
Rara vez la miastenia grave mejora tras el tratamiento del hipertiroidismo, por
lo que los detalles de la relación entre las dos enfermedades son todavía
desconocidos.
Algunas manifestaciones neurológicas a las que se atribuye
una dudosa relación con la tirotoxicosis son: el pseudotumor cerebral (pseudotumor cerebri), la esclerosis lateral amiotróficay el síndrome similar
al de Guillain-Barré.
Diagnóstico
El examen físico puede revelar:
- Presión
arterial sistólica (el primer número en una lectura de la presión arterial) alta
- Reflejos
hiperactivos
- Aumento
de la frecuencia cardíaca
- Agrandamiento
de la tiroides
- Temblor
El hipertiroidismo subclínico es una forma leve de
hipertiroidismo que se diagnostica por medio de niveles sanguíneos anormales de
hormonas tiroideas, a menudo sin ningún síntoma.
También se hacen exámenes de sangre para medir los niveles de
hormonas tiroideas.
- Nivel
de TSH (hormona
estimulante de la tiroides) que usualmente está bajo
- Niveles
de T3 y T4 libre que generalmente son altos
Esta enfermedad también puede afectar los resultados de los
siguientes exámenes:
- Examen
de colesterol
- Examen de glucosa
- Captación de yodo radiactivo
Se realiza a través de un análisis de sangre, midiendo los
niveles de T4. Un alto nivel de esta hormona indica la presencia de
hipertiroidismo (valores normales de T4: 4.5 - 11.2 μg/dl;4 y T4 libre: 0.8 - 1.9 ng/dl). Si el índice de sospecha es bajo, muchos doctores
prefieren medir hormona estimulante de la tiroides (TSH). Si la TSH se suprime, puede haber una producción
descontrolada de T4, mientras que una TSH normal generalmente descarta una
enfermedad tiroidea. La medición de anticuerpos, como el
anti-receptor TSH, contribuye al diagnóstico. El hipertiroidismo por lo general
es curable y sólo rara vez es potencialmente mortal. Algunas de sus causas
pueden desaparecer sin tratamiento.
El hipertiroidismo causado por la enfermedad de Graves
generalmente empeora con el tiempo. Tiene muchas complicaciones, algunas de las
cuales son graves y afectan la calidad de vida.
Tratamiento
El tratamiento del hipertiroidismo es crucial para la
prevención de complicaciones derivadas, como pueden ser enfermedades cardíacas
o incluso dar lugar a una situación de altísima gravedad llamada tirotoxicosis (crisis hipertiroidea). Los posibles
tratamientos de los que se dispone para esta patología son tres: cirugía, yodo radiactivo y medicación antitiroidea (tionamidas: metimazol, carbimazol y propiltiouracilo).
Cirugía
La tiroidectomía (extirpar la glándula en su totalidad o
parcialmente) es un tratamiento muy común para tratar el hipertiroidismo. Se
basa en la extirpación de la fuente de producción de hormonas tiroideas con la
finalidad de restablecer los valores plasmáticos normales de éstas. Es una
intervención sencilla y segura, aunque puede dar lugar a ciertas complicaciones
por consecuencia directa de la "inhabilitación" de la glándula,
pudiendo dar lugar a hipotiroidismo, o por algún error
durante el procedimiento, como la extirpación accidental de las glándulas paratiroides.
Yodo
radiactivo
También se puede hacer frente utilizando diferentes métodos
menos agresivos como puede ser el tratamiento con yodo radiactivo (todo
dependerá del caso concreto del paciente).
El yodo radiactivo se administra oralmente (líquido o en
pastillas), en una sola toma, para eliminar la glándula hiperactiva. El yodo
administrado es distinto al que se usa para el examen radiológico. El
tratamiento con yodo radiactivo se realiza una vez se ha confirmado el tiroides
hiperfuncionante por medio de una radiografía con yodo marcado (estándar oro).
El yodo radiactivo es absorbido por las células tiroideas y se destruyen. La
destrucción es específica, ya que sólo es absorbido por estas células, por lo
que no se dañan otros órganos cercanos. Esta técnica se emplea ya desde los
años 50'. No debe administrarse durante el embarazo ni tampoco durante la lactancia.
La dosis exacta es difícil de determinar, por lo que
frecuentemente, debido al exceso de administración, puede desencadenarse un
hipotiroidismo. Este hipotiroidismo será tratado con levotiroxina, que es la hormona
tiroidea sintética.
Medicamentos
Los fármacos no son utilizados para su tratamiento y en su
contra son los denominados fármacos antitiroideos, los cuales bloquean la
acción de la glándula tiroides y, por consiguiente, impiden la producción de
hormonas tiroideas. Dentro de este grupo de medicamentos, los que
principalmente se utilizan son: el carbimazol, el metimazol y elpropiltiouracilo.
También se utilizan antagonistas de los receptores beta-adrenérgicos, como el propranolol. Otros beta
bloqueantes son también útiles para controlar los síntomas, como profilaxis
antes de la cirugía de tiroides o de la administración de antitroideos.
Los bloqueadores de la conversión de T3 - T4 producen una rápida
disminución de los niveles circulantes de las hormonas tiroideas, antes de la
intervención quirúrgica, cuando otros medicamentos son ineficaces o están
contraindicados, durante el embarazo cuando los medicamentos antitiroideos no sean tolerados; con
fármacos antitiroideos para el tratamiento del hipertiroidismo inducido por amiodarona.
Factores de riesgo
El hipertiroidismo tiende a ser hereditario y
es más común en mujeres que en hombres. Lee más acerca de los factores de riesgo del hipertiroidismo.
Pronostico
El hipertiroidismo por lo general es curable y
sólo rara vez es potencialmente mortal. Algunas de sus causas pueden
desaparecer sin tratamiento.
El hipertiroidismo causado por la enfermedad de
Graves generalmente empeora con el tiempo. Tiene muchas complicaciones, algunas
de las cuales son graves y afectan la calidad de vida.
Complicaciones
La crisis tiroidea, también llamada tirotoxicosis, es un empeoramiento
súbito de los síntomas del hipertiroidismo que puede suceder con infección o
estrés. Se puede presentar fiebre, disminución de la lucidez mental y dolor
abdominal, lo cual requiere hospitalización inmediata.
Otras complicaciones del hipertiroidismo abarcan:
- Complicaciones
relacionadas con el corazón, como:
- Aumenta
del riesgo de osteoporosis si
el hipertiroidismo se presenta por mucho tiempo.
- Complicaciones
relacionadas con la cirugía, como:
- cicatrización
del cuello
- ronquera
debido al daño a un nervio de la laringe
- nivel
bajo de calcio debido a daño en las glándulas paratiroides (localizadas
cerca de la glándula tiroides)
- Los tratamientos para el hipotiroidismo, como yodo
radiactivo, cirugía y medicamentos para reponer las hormonas tiroideas,
pueden tener efectos secundarios.
Cuidados de enfermería
• En la
cabecera de la cama el tratamiento de la tetania; se dispondrá de una vía aérea,
equipo de aspiración, oxígeno, gluconato cálcico y un equipo de traqueotomía.
• El
gluconato cálcico se administrará por vía intravenosa muy lentamente pues es un
irritante de las venas; durante su administración el enfermo dispondrá de
monitorización cardiaca.
• También se
prepararán fármacos anticonvulsivantes por si fuese preciso. La ansiedad puede
provocar hiperventilación que causa alcalosis respiratoria, ésta se debe evitar
utilizando una bolsa de papel o un aparato de respiración cerrada.
• Educar
sobre los medicamentos y la importancia del seguimiento médico regular.
HIPOPARATIROIDISMO
El hipoparatiroidismo es un trastorno
causado por la hipofunción de las glándulas paratiroides, caracterizada por una muy baja concentración de hormona paratiroidea (PTH), de calcio y un
aumento en la concentración de fósforo sanguíneo. La PTH es
la hormona encargada de mantener los niveles normales de calcio en el suero
sanguíneo, favoreciendo su absorción en el tracto
digestivo por medio de la activación de la vitamina
D3 en el riñón con su subsiguiente
migración hacia en epitelio intestinal y la
resorción ósea aumentando
indirectamente la actividad de los osteoclastos en el hueso, aparte
del incremento de la captación por parte de los túbulos distales de las
nefronas que reabsorben este mineral.
El hipoparatiroidismo es el estado patológico resultante
de la falta continuada de producción de la hormona paratiroidea (PTH).
Las glándulas paratiroides son unas glándulas,
habitualmente en número de 4, situadas en la parte anterior del cuello y por
detrás de la glándula tiroides. En ocasiones, alguna de las 4 glándulas puede
estar situadas algo alejadas del cuello. Y no siempre son 4 glándulas; puede
ser entre 2 y 6 glándulas.
Estas glándulas producen la PTH, que es la
hormona reguladora del nivel de calcio en el organismo. Esta hormona aumenta el
calcio en la sangre. Cuando el nivel de calcio en sangre disminuye (por
ejemplo, en dietas con poco o nada de calcio), las células de estas glándulas
fabrican y liberan PTH a sangre. La PTH se une a las células del riñón y del
hueso para producir el aumento del calcio en sangre: el riñón no elimina tanto
calcio hacia la orina y el hueso libera calcio de su estructura.
Además, la PTH estimula la síntesis de vitamina
D por el riñón; la vitamina D aumenta la absorción de calcio en el intestino,
lo que ayuda a aumentar el nivel de calcio en sangre. A su vez, la secreción de
PTH hace perder fósforo por el riñón, produciendo el descenso del nivel de
fósforo en sangre. Cuando se normaliza el nivel de calcio en sangre, las
glándulas paratiroides dejan de fabricar PTH.
El calcio es un elemento esencial para fabricar
nuestros huesos y dientes. Pero en cantidades menores de las necesarias y de
forma mantenida (hipoparatiroidismo), esa falta de calcio va a impedir que se
forme (se recambie) el hueso o se formen los dientes y existe un alto riesgo de
fracturas.
De igual modo, cuando el calcio está en
cantidades mayores de las necesarias y de forma mantenida
(hiperparatiroidismo), ese exceso de calcio se deposita en otros tejidos, como
por ejemplo el riñón, vasos sanguíneos y articulaciones, y los calcifica o
endure. La calcificación de estos otros tejidos produce su mal funcionamiento.
Por todo ello es importante mantener el nivel
de calcio entre unos límites "normales", que vienen definidos por una
concentración de calcio en sangre entre 8’5 y 10’5 mg/dL (= 2’1-2’6 mmol/L).
Sin embargo, hay trastornos que originan una disminución o ausencia continuada
de PTH y que, en consecuencia, van a mantener unas cifras de calcio por debajo
de los valores normales de forma constante (hipocalcemia) y altos de fósforo
(hiperfosfatemia).
Las causas de hipoparatiroidismo las podemos
dividir en tres grandes grupos desde un punto de vista conceptual y funcional:
Hipoparatiroidismo primario: Con
este nombre se incluyen todos los trastornos que se originan en las propias
glándulas paratiroides y que se caracterizan por la disminución o ausencia de
PTH en sangre y los consiguientes niveles de calcio constantemente bajos
(hipocalcemia) y niveles constantemente altos de fósforo (hiperfosfatemia).
La falta
de PTH en sangre puede ser debida a que no existan las glándulas paratiroides,
o a que las glándulas paratiroides tengan un defecto en la fabricación de PTH.
La ausencia de glándulas paratiroides puede ser congénita (ya desde el
nacimiento), como en el síndrome de Di George, o adquirida (tras la extirpación
quirúrgica de las glándulas paratiroides o tras el tratamiento con radioterapia
sobre el cuello o con yodo radiactivo).
En el caso de defecto en la fabricación de PTH,
las glándulas paratiroides son normales pero no fabrican la hormona. La falta
de fabricación de PTH se conoce como hipoparatiroidismo idiopático; es muy poco
frecuente y puede ser por un defecto aislado de la función de las glándulas
paratiroides (hipoparatiroidismo aislado), o bien familiar (hipoparatiroidismo
familiar) y en el contexto de alteraciones de otras glándulas endocrinas como
las glándulas suprarrenales, la glándula tiroides y el páncreas (diabetes
mellitus).
Hiperparatiroidismo secundario: Hay
una falta de PTH e hipocalcemia debido a un fallo de las glándulas paratiroides
provocado por bajos niveles de magnesio en sangre (hipomagnesemia).
Seudohipoparatiroidismo (o
hipoparatiroidismo "no verdadero"): La PTH se fabrica y se libera a
sangre pero esta PTH no es eficaz porque los órganos donde tiene que actuar
(hueso y riñón) no responden a la hormona, por lo que se produce una bajada del
calcio en sangre. Ello induce un aumento secundario de PTH, pero la PTH sigue
siendo inefectiva. A efectos prácticos es como si no hubiese fabricación de PTH
aunque sí hay PTH en sangre; de ahí el nombre de seudohipoparatiroidismo.
En el hipoparatiroidismo "verdadero"
no hay PTH o hay muy poca. El seudohipoparatiroidismo es un trastorno
hereditario caracterizado por signos y síntomas de hipoparatiroidismo que se
asocian a defectos peculiares del desarrollo esquelético.
Causas
Esta patología puede ser producida por una variada gama de
factores, entre los que encontramos:
·
La extirpación quirúrgica accidental o intencional durante la tiroidectomía, siendo esta la causa más
frecuente
·
Dentro de las causas no quirúrgicas los procesos autoinmunes
son los más importantes, encontrando dentro de ellos el síndrome
poliglandular autoinmune
·
La Ausencia o disfunción congénita de la glándula
paratiroides la cual se ha relacionado con microdelecciones dentro del cromosoma 22q11 (síndrome de DiGeorge)1
·
La Hemocromatosis, causante de un cuadro de
disfunción de los órganos endocrinos debido al acumulo de hierro en el interior
de las células
Las glándulas paratiroides ayudan a controlar el uso y la
eliminación del calcio por parte del cuerpo. Esto lo hacen produciendo hormona
paratiroidea, o PTH, que ayuda a controlar los niveles de calcio, fósforo y
vitamina D dentro de la sangre y el hueso.
El hipoparatiroidismo ocurre cuando las glándulas producen
muy poca PTH. Los niveles de calcio en la sangre bajan y los niveles de fósforo
se elevan.
La causa más común del hipoparatiroidismo es la lesión a las
glándulas paratiroides durante una cirugía de cabeza y cuello. Esta afección
casi nunca es un efecto secundario del tratamiento con yodo radiactivo para elhipertiroidismo.
El hipotiroidismo también puede ser causado por:
- Niveles bajos de magnesio en la sangre
- Alcalosis metabólica
El síndrome de DiGeorge es una enfermedad infantil en la cual
el hipoparatiroidismo se presenta a causa de la ausencia total de las glándulas
paratiroides al nacer. El hipoparatiroidismo familiar se presenta con otras
enfermedades endocrinas, como la insuficiencia suprarrenal, en un síndrome denominado
síndrome autoinmunitario poliglandular tipo I (PGA I, por sus siglas en
inglés).
Los factores de riesgo para el hipoparatiroidismo
abarcan:
- Antecedentes
familiares de trastornos de paratiroides
- Enfermedades
autoinmunitarias, tales como la enfermedad de Addison
- Operación
reciente de la glándula tiroides o del cuello
·
Patología
Siendo el calcio uno de los iones más importantes en el mantenimiento de la
homeostasia normal del cuerpo, además de estar con implicado en la contracción
del músculo esquelético estriado, liso y cardiaco, cualquier variación en sus
concentración desencadena un alto número de desordenes funcionales todo esto
producido en el caso del hipoparatiroidismo por la disminución del potencial de acción, lo que lleva al
aumento de la excitabilidad celular, favoreciendo en el caso del músculo la aparición de tetania y el SNC de convulsiones.
Además de esto el calcio está relacionado con los procesos de
secreción glandular favoreciendo la unión de las vesículas de secreción a la
pared celular promoviendo así suexocitosis, la disminución de
este mineral afecta significativamente este suceso lo que se ve dilucidado en
la reducción de la sudoración que presentan los paciente que tienen este
proceso patológico
Síntomas
Los síntomas de hipoparatiroidismo van a venir
derivados de la disminución de los niveles de calcio en sangre. En casos de
descensos del calcio poco importantes y durante largo tiempo, los síntomas
serán de muy poca intensidad. Si la disminución de calcio es considerable o si
se produce en poco tiempo, los síntomas serán más acusados.
Los síntomas de la hipocalcemia aparecen en
ambas formas de hipoparatiroidismo primario (hereditario y adquirido), en el
pseudohipoparatiroidismo y en el hipoparatiroidismo secundario al descenso de
magnesio en sangre, aunque habitualmente el hipoparatiroidismo hereditario y el
pseudohipoparatiroidismo comienzan de un modo más gradual y se asocian a
defectos del desarrollo que no aparecen en los otros.
Los síntomas típicos de la hipocalcemia son los
siguientes:
Alteraciones neuromusculares: Hay un aumento de la excitabilidad de los
músculos y los nervios que los inervan, lo que produce espasmos musculares,
sensación de hormigueo y calambres por la boca y espasmos de manos y pies
(tetania), pudiendo llegar a producirse convulsiones (especialmente en los
niños). La tetania se puede poner de manifiesto en la exploración física
(signos de Chvostek y de Trousseau).
Alteraciones mentales: Pueden ir desde irritabilidad hasta depresión,
neurosis y psicosis.
Alteraciones del sistema nervioso central:
Pérdida de memoria, parkinsonismo y movimientos involuntarios de las
extremidades. En casi el 20% de individuos con hipocalcemia mantenida pueden
observarse calcificaciones intracraneales por rayos X, que justifican los
síndromes de tipo parkinsoniano.
Alteraciones cardíacas: Se producen anomalías en la conducción del
estímulo eléctrico por el corazón en forma de arritmias, prolongación del
intervalo QT, alteraciones de la onda T, y bloqueos cardíacos. También puede
aparecer insuficiencia cardíaca, es decir, incapacidad del corazón para
impulsar la sangre.
Alteraciones en la piel y anejos: Aparece piel seca y
escamosa, con uñas quebradizas y pelo áspero. También puede caerse el cabello
(alopecia). Hay una mayor frecuencia de infección de la piel por hongos como
Candida. Estas alteraciones suelen observarse exclusivamente en el
hipoparatiroidismo hereditario asociado a la insuficiencia de varias glándulas
endocrinas.
Alteraciones oculares: En hipocalcemias de larga duración aparecen
cataratas por alteraciones del cristalino.
En niños son frecuentes las anomalías
dentarias: esmalte defectuoso, falta de desarrollo dental y retraso en la
erupción de los dientes.
También pueden presentarse otras alteraciones
según la causa particular de hipoparatiroidismo: raquitismo, osteomalacia,
deformidades esqueléticas, etc.
Pruebas
y Examenes
Se harán exámenes de sangre para verificar los niveles de
calcio, fósforo, magnesio y PTH. Un ECG puede mostrar ritmos cardíacos anormales.
Se puede
hacer un examen de orina para determinar cuánto calcio se está eliminando del
cuerpo.
Diagnóstico
El diagnóstico de hipoparatiroidismo se realiza
en base a la detección de un calcio en sangre bajo. Los valores de fósforo y de
PTH serán diferentes según la causa del hipoparatiroidismo. El análisis de
sangre se puede haber hecho ante la sospecha clínica por parte del médico del
paciente pero, en ocasiones, la clínica puede ser muy leve y ser entonces un
"hallazgo casual".
En el hipoparatiroidismo primario el calcio en
sangre es bajo y el fósforo alto, con una PTH ausente o baja. En el déficit de
magnesio el calcio y el fósforo en sangre son bajos y la PTH es baja o ausente.
En el pseudohipoparatiroidismo hay poco calcio y poco fósforo en sangre y la
PTH es alta; además, la hipofosfatemia es más acentuada que la hipocalcemia por
la mayor secreción de PTH, que tiene una eficacia solamente parcial para elevar
el calcio en la sangre, pero que favorece la excreción de fósforo por el riñón.
En el hipoparatiroidismo por déficit de magnesio, las cifras de magnesio en
sangre son, lógicamente, bajas.
En la orina debe haber abundante calcio y
valores bajos de fósforo en el hipoparatiroidismo primario. En el
pseudohipoparatiroidismo hay calcio alto en orina y el fósforo generalmente es
bajo.
Si existe sospecha de un déficit de vitamina D
como causa del hipoparatiroidismo, será útil analizar sus niveles en sangre,
que serán bajos en la mayoría de casos.
El interrogatorio y la exploración médica
ayudarán a encontrar el origen del hipoparatiroidismo y a solicitar otros
estudios. Por ejemplo, la aparición reciente de hipocalcemia en un adulto hace
pensar en deficiencia nutricional, insuficiencia renal o trastornos
intestinales que producen deficiencia o ineficacia de la vitamina D.
Las intervenciones quirúrgicas del cuello,
aunque sean antiguas, se pueden asociar al desarrollo de hipoparatiroidismo al
cabo del tiempo. El antecedente de un trastorno convulsivo orienta a los
fármacos antiepilépticos como causa. Los defectos del desarrollo, especialmente
en la niñez y adolescencia, orientan a veces al diagnóstico del
seudohipoparatiroidismo.
El raquitismo y diversos síndromes y
deformidades neuromusculares pueden indicar una acción ineficaz de la vitamina
D, bien por carencia de la misma o bien por defectos de su metabolismo.
En los hipoparatiroidismos primarios se deben
utilizar técnicas de imagen y funcionales de las glándulas paratiroides en
busca de una falta parcial o total de las mismas. Incluyen la ecografía, la
tomografía (TC) y la resonancia magnética del cuello. La gammagrafía con
tecnecio marcado (99Tc) nos permite conocer si estas glándulas funcionan o no.
Pueden estar indicadas otras técnicas como
estudiar la densidad ósea (columna lumbar, cadera) para ver las repercusiones
del hipoparatiroidismo sobre el hueso.
Variantes clínicas
·
Pseudohipoparatiroidismo: En este cuadro, además de los datos
descritos, se añaden trastornos constitucionales como talla corta, cara ancha,
y metacarpianos ymetatarsianos cortos.
·
Pseudo-pseudohipoparatiroidismo: En el que sólo aparecen los trastornos constitucionales
descritos, sin alteración del calcio.
·
Tratamiento
El tratamiento consistiría en la administración de la hormona
paratiroidea (PTH) pero principalmente de la administración de calcio y
vitamina D en caso de que se trate de la verdadera forma del hipoparatiroidismo
la cual presenta bajos niveles de calcio sérico.
El objetivo del tratamiento es restaurar el equilibrio del
calcio y minerales en el organismo.
El tratamiento consiste en suplementos de carbonato de calcio
y vitamina
D,
que generalmente se tienen que tomar de por vida. Se miden regularmente los
niveles en la sangre para constatar que la dosis sea correcta. Se recomienda
una dieta alta en calcio y baja en fósforo.
A las personas que tienen ataques de bajos niveles de calcio
potencialmente mortales o contracciones musculares prolongadas se les
suministra calcio por vía intravenosa. Se toman precauciones para prevenir
convulsiones o espasmos de la laringe y se vigila el corazón para detectar
ritmos anormales hasta que la persona se estabiliza. Una vez controlado el
episodio potencialmente mortal, el tratamiento continúa con medicamentos orales.
El tratamiento
es principalmente médico y va a consistir (en el hipoparatiroidismo primario)
en dar al paciente suplementos de calcio para corregir los síntomas que puedan
existir. Los pacientes con hipoparatiroidismo deben tomar 2 a 3 g/día de calcio
elemental por vía oral. En los casos graves que cursan con tetania es preciso
el tratamiento con calcio por vía endovenosa y con el paciente ingresado en el
hospital.
Junto al
calcio oral se administrará vitamina D (o su forma activa, el calcitriol), ya
que así se favorece la absorción del calcio a nivel intestinal y se impide su
pérdida renal.
En general, el
tratamiento con calcio y con vitamina D (o calcitriol) son suficientes para
normalizar el calcio y el fósforo en sangre, aunque no permite corregir la
excesiva eliminación de calcio por la orina y el riesgo de hacer cálculos
renales que esto conlleva; añadimos un tratamiento con diuréticos como la
hidroclorotiazida para prevenir este problema.
Por otro lado,
si los niveles de fósforo en sangre persisten altos hay que restringir el
fósforo de la dieta y, si es preciso, añadir hidróxido de aluminio al
tratamiento (que se une al fósforo en el intestino y evita su absorción).
El tratamiento
del seudohipoparatiroidismo es similar al del hipoparatiroidismo primario,
salvo que las dosis de calcio y vitamina D suelen ser menores que las que se
necesitan en el hipoparatiroidismo primario o "verdadero".
La
hipocalcemia asociada a hipomagnesemia incluye la corrección de los niveles de
magnesio en sangre.
En las
deficiencias de vitamina D el tratamiento consiste en administrar vitamina D (o
calcitriol) y calcio hasta normalizar el calcio en sangre y después continuar
con vitamina D (o calcitriol) exclusivamente.
Pronostico
Si se hace un diagnóstico
temprano, es probable que el desenlace clínico sea bueno. Sin embargo, los
cambios en los dientes, las cataratas y las calcificaciones cerebrales son irreversibles.
Complicaciones
En los niños, el hipoparatiroidismo puede llevar a
crecimiento deficiente, dientes anormales y desarrollo mental lento.
El tratamiento excesivo con vitamina D y calcio puede
producir hipercalciemia (niveles altos de calcio en la sangre) y algunas veces
interferir con el funcionamiento renal.
El hipoparatiroidismo incrementa el riesgo de:
- Enfermedad
de Addison
- Cataratas
- Mal de Parkinson
- Anemia perniciosa
Medidas preventivas
No existen medidas específicas para prevenir la
aparición de un hipoparatiroidismo, pero se puede sospechar en casos de
alteraciones del esqueleto en un niño, o en casos de cirugía o radioterapia
previas sobre el cuello. También se sospechará en casos de familiares con
descensos del calcio.
Ante cualquier sospecha debe practicarse una
analítica de sangre que incluya niveles de calcio y fósforo, que suele ser
suficiente para realizar una detección precoz de la enfermedad, y que se
confirmará con los valores de la PTH.
Cuidados de enfermería
•
Aumentar la ingestión de calorías y proteínas (por su estado hipercatabólico),
y reducir la ansiedad (está muy nervioso y activo).
•
Evitar el estreñimiento y se fomentará su independencia y autocuidado.
•
Tratamiento farmacológico: levotiroxina (T4) por vía oral únicamente. Se inicia
a dosis bajas (para evitar los síntomas de hipertiroidismo), aumentando cada 2
ó 3 semanas, según la clínica
.•
Objetivos:• desaparecer la edema, aumentar la frecuencia cardíaca, mejorar el
apetito y disminuir el estreñimiento



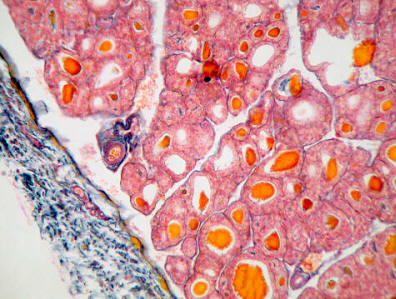
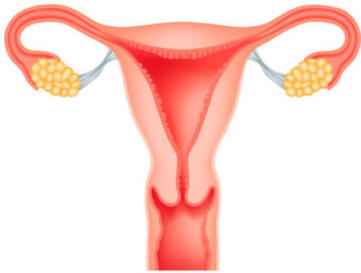






No hay comentarios:
Publicar un comentario